Orchideen Schädlinge
Tierische Schädlinge an Phalaenopsis und anderen Orchideen Gattungen
In der professionellen Produktion von Phalaenopsis kommt es immer wieder zu einem Befall durch Insekten, Spinnen und anderen tierischen Schädlingen. Nachfolgend sind die wirtschaftlich wichtigsten Schädlinge mit Ihrer Biologie, dem Schadbild und Bekämpfungsmöglichkeiten aufgeführt. Empfohlene chemische Bekämpfungen sind mit den jeweils gültigen Zulassungsbestimmungen Ihres Landes abzugleichen. Alle Pflanzenschutzempfehlungen erfolgen mit dem Ausschluss jeglicher Haftung.
Asseln
Biologie
Asseln (Isopoda) gehören zu den Krebstieren, sie sind von breiter, ovaler bis länglicher Gestalt. Die Größe variiert von 3 mm kleinen Tieren bis zu 20 mm großen in Gewächshäusern vorkommenden Kugelasseln (Armadillidium sp.), Kellerasseln (Porcellio scaber Latr.) und Mauerasseln (Oniscus asellus L.). Die meisten Asseln sind unscheinbar grau gefärbt, Kugelasseln auch schwarz bis schwarzbraun, Körper immer mit sieben Beinpaaren. Die Tiere lieben dunkle, feuchte und warme Habitate. Tagsüber leben sie versteckt in Töpfen, unter Moos, in Substraten oder ähnlich geschützten Stellen. Bevorzugte Nahrung ist abgestorbenes, verrottendes Pflanzenmaterial, in Ausnahmefällen und bei hoher Populationsdichte aber auch junges, frisches Pflanzengewebe.
Schadbild
Das Schadbild ist ähnlich dem der Schnecken, allerdings ohne Schleimspuren. Überwiegend sind junge, frische Pflanzenteile geschädigt, wobei in erster Linie Keimlinge, Luftwurzeln oder Wurzelspitzen angefressen werden. Aber auch Blütenstiele können unter Umstände befallen werden. Durch die Fraßtätigkeit kann die Struktur der Substrate zum Teil erheblich zerstört werden.
Bekämpfung
Die Verwendung sauberer, strukturstabiler Substrate beugt einem Befall vor. Sinnvoll kann auch die Beseitigung von Schlupfwinkeln in Gewächshäusern sein. Direkte Bekämpfung mit chemischen Präparaten ist nur wenig erfolgreich, am besten wirken Methiocarbhaltige Ködermittel, die auch gegen Schnecken eingesetzt werden. Nach dem Topfen kann auch Carbofuran (Curaterr-Granulat, Carbosip) in das Substrat eingestreut werden.
Biologischer Pflanzenschutz
Nach ersten Erfahrungen kann gegen Larven der Schädlinge auch mit insektenpathogenen Nematoden (Steinernema feltiae Filipjev) gegossen werden. In Versuchen war der Schädlingsbesatz gegenüber der Kontrolle in den ersten 2-3 Wochen um 50-70 % reduziert.
Blattläuse
Biologie
Blattläuse sind 1,0-4,0 mm kleine, geflügelte oder ungeflügelte Insekten mit langen Beinen und Fühlern. Die Entwicklung verläuft in verschiedenen Zyklen ab, ist vielfach kompliziert und soll hier nicht näher beschrieben werden. In Gewächshäusern findet häufig Jungfernzeugung (Partheno- genese) statt, die Weibchen zeugen regelmäßig Jungtiere ohne befruchtet zu sein. Daraus resultiert eine extrem hohe Vermehrungsfähigkeit, es kommt in der Regel zur Bildung von Befallsnestern mit hoher Populationsdichte.
Dabei werden vor allem junge Triebe und weiche Blätter sowie Blüten besiedelt. Der Körperbau von Blattläusen hat einige deutliche Merkmale. Der Saugrüssel ist in Ruhestellung nach hinten geklappt und befindet sich unter dem Körper. Am Hinterteil befinden sich seitlich sogenannte Rückenröhrchen (Siphonen), aus denen ein Sekret abgegeben wird. Dazwischen liegt das Schwänzchen (Cauda). Sowohl Cauda als auch Siphonen sind für die Artbestimmung von großer Bedeutung.
Blattläuse an Orchideen sind sämtlich Phloemsauger, deshalb kommt es auch zu erheblicher Bildung von Honigtau. Blattlausbefall birgt die Gefahr der Virusübertragung, vermutlich sind einige Arten Vektoren für das Kurze Orchideen-Rhabdovirus (KORV).
Dabei werden vor allem junge Triebe und weiche Blätter sowie Blüten besiedelt. Der Körperbau von Blattläusen hat einige deutliche Merkmale. Der Saugrüssel ist in Ruhestellung nach hinten geklappt und befindet sich unter dem Körper. Am Hinterteil befinden sich seitlich sogenannte Rückenröhrchen (Siphonen), aus denen ein Sekret abgegeben wird. Dazwischen liegt das Schwänzchen (Cauda). Sowohl Cauda als auch Siphonen sind für die Artbestimmung von großer Bedeutung.
Blattläuse an Orchideen sind sämtlich Phloemsauger, deshalb kommt es auch zu erheblicher Bildung von Honigtau. Blattlausbefall birgt die Gefahr der Virusübertragung, vermutlich sind einige Arten Vektoren für das Kurze Orchideen-Rhabdovirus (KORV).
Wichtige Blattlausarten
Grüne Pfirsichblattlaus (Myzus persicae Sulz.): Grünlich bis rötlich gefärbt mit körperlangen Fühlern, ausgeprägte Stirnhöcker, 1,2-2,6 mm lang. Resistenzen gegen diverse Insektizide.
Grüne Gurkenlaus, Baumwolllaus (Aphis gossypii Glover): Dunkelgrün marmoriert, hellgrün bis gelb mit dunklen Siphonen, fehlende Stirnhöcker, starke Honigtaubildung, 0,9-1,8 mm lang. Ausgeprägte Resistenzneigung, z.B. gegen Pirimicarb .
Grünfleckige Kartoffelblattlaus (Aulacorthum solani Kalt.): Hellgrün gefärbt mit überkörperlangen Fühlern, Siphonen mit dunkler Spitze, Siphonenansatz mit dunkelgrünen Flecken, länglich mit spitz zulaufendem Hinterleib, 1,8-3,0 mm lang.
Grünstreifige Kartoffellaus (Macrosiphum euphorbiae Thomas): Gelblich-grün gefärbt mit schwarzen Siphonen und überkörperlangen Fühlern, 1,7-3,6 mm lang.
An Orchideen können außerdem die Gefleckte Gewächshauslaus (Myzus circumflexus Buckton) und die Gepunktete Gewächshauslaus (Myzus ornatus Laing.) vorkommen. Im Einzelfall muss eine Differentialdiagnose durch Fachleute vorgenommen werden.
Grüne Gurkenlaus, Baumwolllaus (Aphis gossypii Glover): Dunkelgrün marmoriert, hellgrün bis gelb mit dunklen Siphonen, fehlende Stirnhöcker, starke Honigtaubildung, 0,9-1,8 mm lang. Ausgeprägte Resistenzneigung, z.B. gegen Pirimicarb .
Grünfleckige Kartoffelblattlaus (Aulacorthum solani Kalt.): Hellgrün gefärbt mit überkörperlangen Fühlern, Siphonen mit dunkler Spitze, Siphonenansatz mit dunkelgrünen Flecken, länglich mit spitz zulaufendem Hinterleib, 1,8-3,0 mm lang.
Grünstreifige Kartoffellaus (Macrosiphum euphorbiae Thomas): Gelblich-grün gefärbt mit schwarzen Siphonen und überkörperlangen Fühlern, 1,7-3,6 mm lang.
An Orchideen können außerdem die Gefleckte Gewächshauslaus (Myzus circumflexus Buckton) und die Gepunktete Gewächshauslaus (Myzus ornatus Laing.) vorkommen. Im Einzelfall muss eine Differentialdiagnose durch Fachleute vorgenommen werden.
Schadbild
Blattläuse schädigen überwiegend die Blüten, bei Befall an jungen Trieben und weichen Blättern ist meist starke Honigtaubildung zu verzeichnen. Als Folge kommt es zur Besiedlung mit Schwärzepilze (Rußtau). Durch Absonderung giftiger Speichel entstehen Missbildungen, Deformationen, Kräuselungen oder Verdrehungen der Blätter.
Bekämpfung
Bei notwendigen Spritzungen mit chemischen Präparaten sind die integrierbaren Wirkstoffe Pirimicarb, Azadirachtin und Pymetrozin zu bevorzugen.
Biologischer Pflanzenschutz
Aufgrund der Fähigkeit zur Massenvermehrung sollte bei Befall möglichst schnell reagiert werden. Der kurative Einsatz von Nützlingen ist bei Orchideen nicht effektiv genug, lediglich die prophylaktische Freilassung von Aphidius-Schlupfwespen wäre möglich, stößt dann allerdings schnell an eine wirtschaftliche Grenze. Bei regelmäßigem Blattlausbefall im Betrieb ist der Aufbau einer "Offenen Zucht" von Blattlaus-Schlupfwespen auf Getreidepflanzen sinnvoll. Der Spontanzuflug diverser Nutzarthropoden in Gewächshäuser kann zu einer erheblichen Reduzierung von Blattläusen führen.
Dickmaulrüssler
Biologie
Rüsselkäfer (Curculionidae) sind eine sehr artenreiche und weltweit verbreitete Käferfamilie, sie gehören zu den wichtigsten Pflanzenschädlingen. Charakteristisch sind der rüsselförmig verlängerte Kopf mit den Mundwerkzeugen. An Orchideen, insbesondere Phalaenopsis, hat vor allem ein Vertreter der Rüsselkäfer Bedeutung. Gefurchter Dickmaulrüssler (Otiorhynchus sulcatus Fabr.): Der Käfer ist ca. 9-12 mm lang, hat eine schwarze Grundfarbe mit einer bräunlichen, metallisch schimmernden, behaarten Oberseite.
Der Rüssel ist relativ kurz, dick und in der Mitte gefurcht. Die Käfer sind flugunfähig, die Eier werden in das Substrat gelegt. Die weißen, fußlosen Larven leben ausschließlich im Boden oder in Substraten. Sie sind etwa 12 mm lang, deutlich erkennbar ist die braun-rote Kopfkapsel. In Orchideensubstraten sind die Larven nicht sehr häufig, allerdings kann bei Verwendung humoser oder torfhaltiger Produkte eine Einschleppung erfolgen. Die Käfer wandern mitunter in Gewächshäuser ein und können sich dort ganzjährig aufhalten.
Der Rüssel ist relativ kurz, dick und in der Mitte gefurcht. Die Käfer sind flugunfähig, die Eier werden in das Substrat gelegt. Die weißen, fußlosen Larven leben ausschließlich im Boden oder in Substraten. Sie sind etwa 12 mm lang, deutlich erkennbar ist die braun-rote Kopfkapsel. In Orchideensubstraten sind die Larven nicht sehr häufig, allerdings kann bei Verwendung humoser oder torfhaltiger Produkte eine Einschleppung erfolgen. Die Käfer wandern mitunter in Gewächshäuser ein und können sich dort ganzjährig aufhalten.
Schadbild
Typische Symptome für die Schädigung durch Käfer des Dickmaulrüssler sind buchtenförmige Fraßspuren an Blättern oder Blüten, die Knospen können abgefressen sein. Larven fressen an unterirdischen Pflanzenteilen, als Folge sterben die Pflanzen ab. In Orchideensubstraten ist aber nur selten mit Larven zu rechnen.
Bekämpfung
Die Einschleppung von Larven mit Substraten muss vermieden werden. Bei Auftreten erster Schadsymptome kann gegen die adulten Käfer mit Kontaktinsektiziden wie Azadirachtin, lamda-Cyhalothrin, Methiocarb, Thiacloprid gespritzt werden. Gegen die Larven ist das Streuen von Carbofuran möglich. Auch Gießbehandlungen mit Imidacloprid sind begrenzt möglich.
Biologischer Pflanzenschutz
Gegen die Larven kann mit insektenpathogenen Nematoden (Steinernema carpocapsae Weiser, Heterorhabditis bacteriophora Poinar) gegossen werden. Die etwa 1 mm langen Nematoden werden im Gießverfahren ausgebracht und bewegen sich im Boden auf die Larven zu. Sie dringen in den Schädling ein und setzen dort ein Bakterium frei, welches die Larven abtötet. Da die Nematoden aber nur bis zum 3. Larvenstadium des Schädlings wirksam sind, müssen Wiederholungen einkalkuliert werden. Biologische Bekämpfungsverfahren sind chemischen Methoden gegen diesen Schaderreger weit überlegen.
Falsche Spinnmilben
Biologie
Falsche oder Unechte Spinnmilben, Orchideenmilben (Tenuipalpidae):
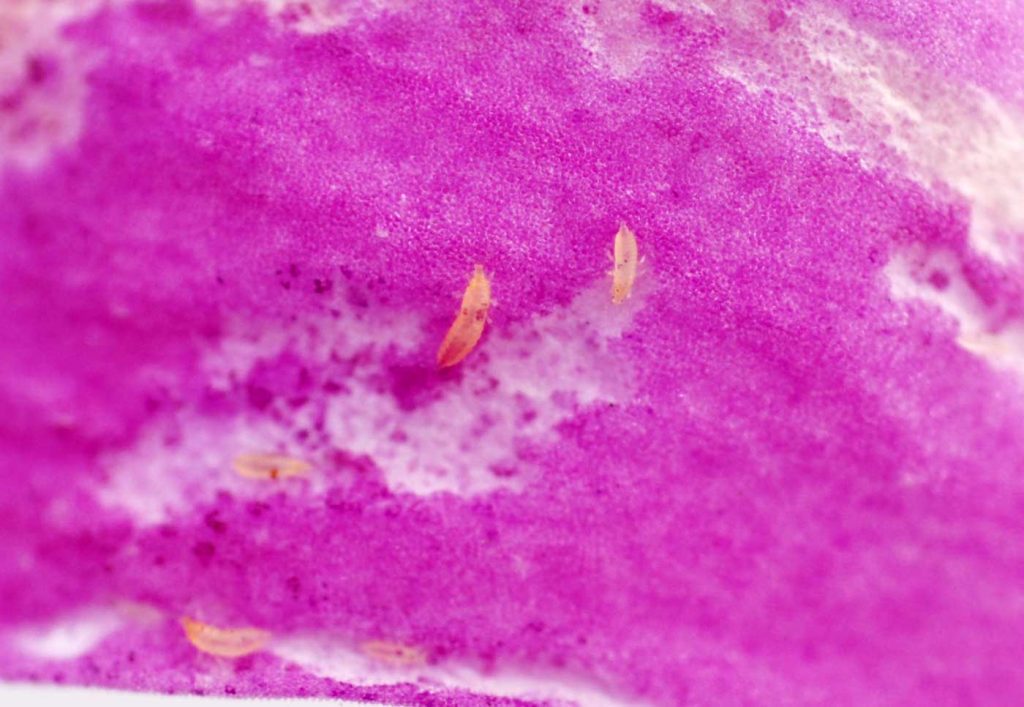
Bei den Tenuipalpidae handelt es sich um mit dem bloßen Auge kaum sichtbare, 0,25-0,3 mm lange, meist grünlich bis rötlich gefärbte Milben mit flacher, ovaler Gestalt. Die Tiere sind relativ träge, erscheinen fast unbeweglich. Im Pflanzenbestand erfolgt eine langsame Ausbreitung der Schädlinge, wenn Schäden sichtbar sind ist der Befall in der Regel schon sehr hoch. Die Milben bilden keine Gespinste aus.
An Orchideen schädigen besonders drei Arten: die Scharlachrote Teemilbe (Brevipalpus californicus Banks), die Rote Gewächshausspinnmilbe (Brevipalpus obovatus Donn.) sowie die Orchideenspinnmilbe (Tenuipalpus pacificus Baker). Der gesamte Entwicklungszyklus beträgt in Abhängigkeit von Temperatur und Luftfeuchte 4-6 Wochen bei Brevipalpus sowie 2 bis 3 Monate bei Tenuipalpus. Brevipalpus obovatus neigt bei Temperaturen über 21°C zur Massenvermehrung.
Die Tiere leben auf allen Pflanzenteilen, werden aber überwiegend auf den Blattunterseiten schädlich. Sie sitzen in großen Mengen meist entlang der Blattadern. Die Milben werden häufig mit Pflanzenmaterial, besonders aus tropischen und subtropischen Bereichen in Gewächshäuser eingeschleppt.
An Orchideen schädigen besonders drei Arten: die Scharlachrote Teemilbe (Brevipalpus californicus Banks), die Rote Gewächshausspinnmilbe (Brevipalpus obovatus Donn.) sowie die Orchideenspinnmilbe (Tenuipalpus pacificus Baker). Der gesamte Entwicklungszyklus beträgt in Abhängigkeit von Temperatur und Luftfeuchte 4-6 Wochen bei Brevipalpus sowie 2 bis 3 Monate bei Tenuipalpus. Brevipalpus obovatus neigt bei Temperaturen über 21°C zur Massenvermehrung.
Die Tiere leben auf allen Pflanzenteilen, werden aber überwiegend auf den Blattunterseiten schädlich. Sie sitzen in großen Mengen meist entlang der Blattadern. Die Milben werden häufig mit Pflanzenmaterial, besonders aus tropischen und subtropischen Bereichen in Gewächshäuser eingeschleppt.
Schadbild
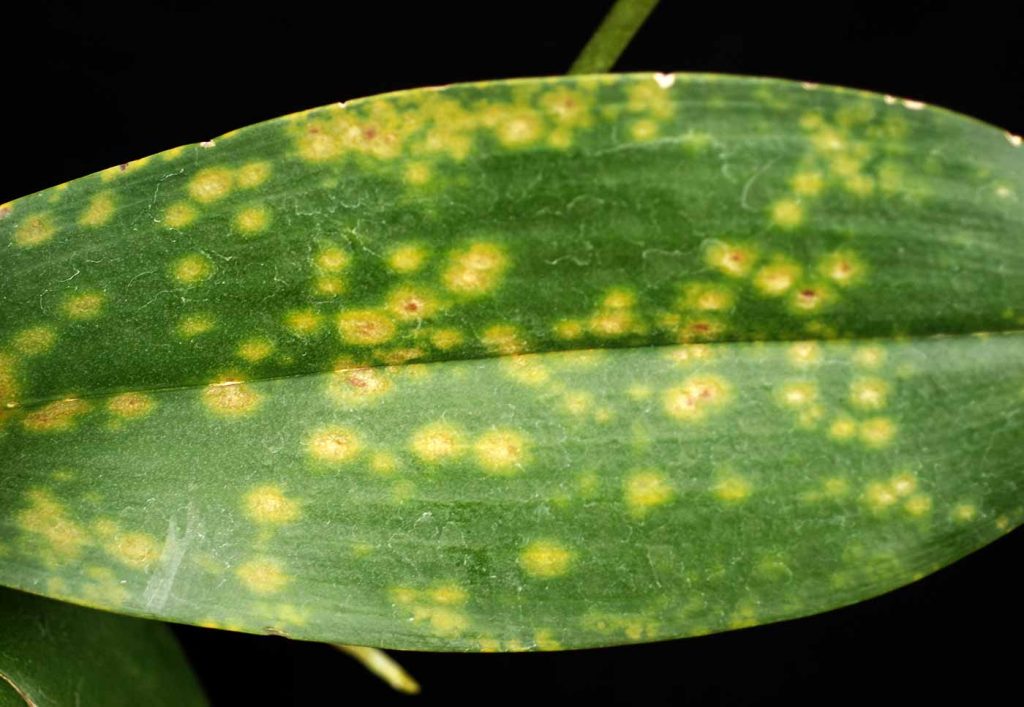
Meist ältere Blätter sind zunächst stumpfgrün, an deren Unterseite sind eingesunkene Flecken sichtbar, blattoberseits silbrige Aufhellungen. Befallene Blätter verfärben sich später bronzefarben bis gelborange. Schadstellen können vernarben, Blätter vertrocknen häufig vom Rand her und fallen schließlich ab. Unter den Blättern keine Spinnfäden. Anfällig für Befall mit Brevipalpus sind alle Orchideen-Arten. Überwiegend treten die Milben aber an Phalaenopsis, Doritinopsis, Paphiopedilum und Masdevallia auf.
Bekämpfung
Im Gegensatz zu den Spinnmilben haben Tenuipalpidae nur einen geringen Aktionsradius und verbreiten sich sehr langsam im Pflanzenbestand. Deshalb brauchen die Milben auch relativ lange um eine schädliche Population aufzubauen. Wenn der Schaden dann auffällig sichtbar ist, sind in der Regel schon viele Milben auf den Pflanzen vorhanden und die notwendige Bekämpfung mit Akariziden wird entsprechend zeitaufwendiger. Chemische Behandlungen mit Abamectin, Spirodiclofen und Tebufenpyrad müssen im Abstand von 2-3 Wochen mit wechselnden Wirkstoffen durchgeführt werden bis die neuen Blätter erkennbar befallsfrei sind.
Biologischer Pflanzenschutz
Brevipalpus kann besonders bei Phalaenopsis eine große Dynamik entwickeln und sich stark verbreiten, solange er ungestört bleibt. Sobald aber ein Gegenspieler dazu kommt wird die Entwicklung entweder vermindert oder bricht bei optimalem Verlauf sogar total ein.
Sicherste und nachhaltigste Bekämpfungsmethode erfolgt daher unbedingt mit Raubmilben.
Brevipalpus sp. lassen sich hervorragend mit Amblyseius swirskii bekämpfen.
Eine Einsatzmenge von 50 Tieren/m², 14 tägig (medium dosage) ausgebracht ist optimal. Diese Menge ist ausreichend um beginnenden Befall von Brevipalpus auf den Pflanzen zu bekämpfen und einen Populationsaufbau nachhaltig zu verhindern.
Ein Ausbringungsintervall von 4 Wochen (low dosage) ist bei symptomfreien Pflanzen prophylaktisch ausreichend. Zur Vermeidung eines Populationsaufbaus reicht diese allerdings nicht aus. Bei sichtbaren ersten Symptomen muss die Einsatzmenge erhöht werden.
100 Tiere/m² (high dosage) ist bei stärkerem Befall zu Beginn sinnvoll, später kann auf die geringere Dosierung reduziert werden.
Der Einsatz von Amblyseius swirskii ist deutlich effektiver als chemische Behandlungen.
Mäuse
Biologie
Mäuse (Arvicolidae und Muridae) gehören zu den Nagetieren und wandern besonders im Herbst sowie in Perioden mit länger anhaltenden Niederschlägen in Gewächshäuser ein. Dort können erhebliche Schäden angerichtet werden. Schädliche Mäuse in Orchideen sind u.a. Erdmaus (Microtus agrestis L.) und Feldmaus (Microtus arvalis Pall.).
Beide Arten gehören zoologisch zu den Wühlmäusen (Arvicolidae) und leben an Feldgehölzen, Waldrändern, Wiesen oder Feldkulturen. Eine weitere Art ist die zu den Echten Mäusen (Muridae) zählende Waldmaus (Apodemus sylvaticus L.). Die Waldmaus kann sehr gut klettern und gelangt ohne Schwierigkeiten auch auf Gewächshaustische.
Die ebenfalls in Gewächshäuser eindringenden Spitzmäuse (Soricidae) ernähren sich überwiegend von Insekten, Asseln, Schnecken, Spinnen und Würmern und sind daher nicht als schädlich anzusehen, sondern können das Potential an Schaderregern sogar erheblich reduzieren.
Beide Arten gehören zoologisch zu den Wühlmäusen (Arvicolidae) und leben an Feldgehölzen, Waldrändern, Wiesen oder Feldkulturen. Eine weitere Art ist die zu den Echten Mäusen (Muridae) zählende Waldmaus (Apodemus sylvaticus L.). Die Waldmaus kann sehr gut klettern und gelangt ohne Schwierigkeiten auch auf Gewächshaustische.
Die ebenfalls in Gewächshäuser eindringenden Spitzmäuse (Soricidae) ernähren sich überwiegend von Insekten, Asseln, Schnecken, Spinnen und Würmern und sind daher nicht als schädlich anzusehen, sondern können das Potential an Schaderregern sogar erheblich reduzieren.
Schadbild
Mäuse schädigen vornehmlich an Knospen und jungen, frischen Blättern von Phalaenopsis, auch Blüten und Blütenstängel werden angefressen. Als Folge können die Blätter so stark geschädigt werden, dass sie abfallen. Zuweilen ziehen Mäuse auch frisch pikierte Jungpflanzen heraus und nagen an den frei liegenden Wurzeln.
Bekämpfung
Zur direkten Bekämpfung in Gewächshäusern eigenen sich Schlagfallen mit entsprechenden Ködern wie Möhren, Nüssen, Äpfeln oder Nuss-Nougat-Cremes. Das Auslegen von Giftködern mit Zinkphosphid oder Chlorphacinon sollte geschützt in speziellen Köderstationen erfolgen.
Moosmilben
Biologie
Horn- oder Moosmilben (Oribatidae) sind meist dunkel gefärbte, glänzende, kugelige Milben. Haut stark chitiniert, hart oder lederartig. Die Tiere sind bodenbewohnend und ernähren sich von Moosen, Algen, Pilzhyphen oder abgestorbenen Pflanzenteilen, kommen häufig in Rindensubstraten vor. Sie gelten normalerweise nicht als Schädling. Die Tiere werden meist mit Rindensubstraten eingeschleppt, so dass die Populationsdichte die Schadschwelle überschreiten kann.
Schadbild
An Phalaenopsis-Jungpflanzen Deformationen jüngerer Blätter mit leichten Blattrandnekrosen. Mit zunehmendem Wachstum schnüren die Schadstellen ein und sich entwickelnde Blätter sind deutlich eingebuchtet. Die jungen, weichen Blätter von Phalaenopsis dienen Moosmilben vermutlich zur Nahrungsergänzung. An Blüten finden sich bei Befall kleine punktförmige Nekrosen und leichte Deformationen.
Bekämpfung
Einschleppung erfolgt überwiegend mit Substraten, die sorgfältige Eingangskontrolle beugt Schäden vor. Bei Auftreten der Milben hohe Luftfeuchtigkeit nach Möglichkeit reduzieren. Spritzungen mit chemischen Präparaten wiederholt durchführen mit Fenpyroximat, Abamectin, Tebufenpyrad, Fenpropathrin.
Biologischer Pflanzenschutz
Gute Möglichkeiten bestehen für den biologischen Pflanzenschutz mit dem Einsatz von Raubmilben (Hypoaspis miles Berl., H. aculeifer Can.). Die Nützlinge sind sehr polyphag und ernähren sich von anderen Bodenmilben, Collembolen (Springschwänze) sowie vielen Insektenlarven. Sie fressen auch die Larven der Hornmilben. In Orchideen können Hypoaspis bei regelmäßiger, prophylaktischer Verwendung viele potentielle Schaderreger dezimieren und deren Populationsaufbau behindern.
Zur direkten Bekämpfung sind Hypoaspis allerdings nur bedingt geeignet, sie müssten dann in großer Menge ausgebracht werden, so dass die Wirtschaftlichkeit nicht mehr gegeben wäre. Die Raubmilben entfalten besonders dann ihre Wirkung, wenn Orchideensubstrate mit Beimischung von Sphagnum zur Verfügung stehen. Die dort vorherrschenden Lebensbedingungen scheinen Hypoaspis in ihrem Vermehrungsdrang regelrecht zu animieren. Unter diesen Bedingungen vermehren sich die Raubmilben sehr gut im Gewächshaus, so dass auch nach einigen Monaten noch genügend Tiere in den Beständen zu finden sind.
Da die Raubmilben ein reichhaltiges Beutespektrum auf der Bodenoberfläche und in der obersten Bodenschicht vertilgen, können es die Tiere relativ lange im Gewächshaus aushalten und mit hohen Populationsdichten bis zu einem halben Jahr aktiv bleiben. Bei Problemen mit Moos- oder Hornmilben kann in Orchideenbetrieben folgende Strategie gefahren werden:
Zunächst wiederholte chemische Behandlungen mit integrierbaren Akariziden wie Tebufenpyrad, Abamectin oder Fenpyroximat. Danach etwa 2-3 mal im Jahr Einsatz von Hypoaspis-Raubmilben (150-250 Tiere/m²) zur Verhinderung eines erneuten Populationsaufbaus.
Zur direkten Bekämpfung sind Hypoaspis allerdings nur bedingt geeignet, sie müssten dann in großer Menge ausgebracht werden, so dass die Wirtschaftlichkeit nicht mehr gegeben wäre. Die Raubmilben entfalten besonders dann ihre Wirkung, wenn Orchideensubstrate mit Beimischung von Sphagnum zur Verfügung stehen. Die dort vorherrschenden Lebensbedingungen scheinen Hypoaspis in ihrem Vermehrungsdrang regelrecht zu animieren. Unter diesen Bedingungen vermehren sich die Raubmilben sehr gut im Gewächshaus, so dass auch nach einigen Monaten noch genügend Tiere in den Beständen zu finden sind.
Da die Raubmilben ein reichhaltiges Beutespektrum auf der Bodenoberfläche und in der obersten Bodenschicht vertilgen, können es die Tiere relativ lange im Gewächshaus aushalten und mit hohen Populationsdichten bis zu einem halben Jahr aktiv bleiben. Bei Problemen mit Moos- oder Hornmilben kann in Orchideenbetrieben folgende Strategie gefahren werden:
Zunächst wiederholte chemische Behandlungen mit integrierbaren Akariziden wie Tebufenpyrad, Abamectin oder Fenpyroximat. Danach etwa 2-3 mal im Jahr Einsatz von Hypoaspis-Raubmilben (150-250 Tiere/m²) zur Verhinderung eines erneuten Populationsaufbaus.
Nichtparsitäre Schäden
Schadbild
Neben vielen Schadbildern an Pflanzen gibt es auch zahlreiche nichtparasitäre Ursachen für Schädigungen an
Phalaenopsis. Die hier aufgeführten Fotos sind nur Beispiele für eine Vielzahl von nichtparasitären Schäden die
an Phalaenospis während einer Kultur auftreten können.
Schildläuse
Biologie
Deckelschildläuse (Diaspidae) und Napfschildläuse (Coccidae oder Lecaniidae) sind kleine bis höchstens mittelgroße Insekten mit ausgeprägtem Geschlechtsdimorphismus, d.h. Männchen und Weibchen unterscheiden sich hinsichtlich Körperform und Größe erheblich voneinander. Die fast immer flügellosen Männchen fehlen häufig völlig oder sind zumindest sehr selten. In diesen Fällen findet Jungfernzeugung (Parthenogenese) statt. Die Weibchen besitzen nie Flügel, der Körper ist gedrungen und nur schwach segmentiert, ohne Fühler und deutlich sichtbare Beine.
Der Körper der Weibchen ist mit einer Wachsschicht versehen, dadurch sind die Tiere gegen äußere Einflüsse gut geschützt. Durch abgeworfene Larvenhäute, Kotreste und andere Substanzen entsteht so während des Entwicklungskreislaufes der namengebende Schild.
Die Vermehrung erfolgt über Eier. Die Dauer der Entwicklung kann je nach Art in wenigen Wochen abgeschlossen sein, so dass viele Generationen entstehen. Während die jungen Larven - die sogenannten Crawler oder Wanderlarven - noch beweglich sind, sitzen die erwachsenen Tiere fast völlig fest auf den Pflanzen. Schildläuse besiedeln bei Orchideen alle Pflanzenteile außer den im Substrat liegenden Wurzeln. Die Schädlinge leben anfänglich sehr versteckt und sind meist nur schwer zu entdecken. Die Gefahr einer Verschleppung ist deshalb groß.
Da die meisten Arten an hohe Temperaturen angepasst sind, ist vor allem bei Importen aus tropischen und subtropischen Regionen mit einem erheblichen Potential zu rechnen. Unter den Schildläusen sind an Orchideen besonders Deckelschildläuse und Napfschildläuse von Bedeutung.
Deckelschildläuse besitzen einen festen, deckelartigen Schild der mit dem Körper nicht verbunden und leicht abnehmbar ist. Die Tiere saugen den Saft einzelner Zellen aus, sind also keine Phloemsauger.
Der Körper der Weibchen ist mit einer Wachsschicht versehen, dadurch sind die Tiere gegen äußere Einflüsse gut geschützt. Durch abgeworfene Larvenhäute, Kotreste und andere Substanzen entsteht so während des Entwicklungskreislaufes der namengebende Schild.
Die Vermehrung erfolgt über Eier. Die Dauer der Entwicklung kann je nach Art in wenigen Wochen abgeschlossen sein, so dass viele Generationen entstehen. Während die jungen Larven - die sogenannten Crawler oder Wanderlarven - noch beweglich sind, sitzen die erwachsenen Tiere fast völlig fest auf den Pflanzen. Schildläuse besiedeln bei Orchideen alle Pflanzenteile außer den im Substrat liegenden Wurzeln. Die Schädlinge leben anfänglich sehr versteckt und sind meist nur schwer zu entdecken. Die Gefahr einer Verschleppung ist deshalb groß.
Da die meisten Arten an hohe Temperaturen angepasst sind, ist vor allem bei Importen aus tropischen und subtropischen Regionen mit einem erheblichen Potential zu rechnen. Unter den Schildläusen sind an Orchideen besonders Deckelschildläuse und Napfschildläuse von Bedeutung.
Deckelschildläuse besitzen einen festen, deckelartigen Schild der mit dem Körper nicht verbunden und leicht abnehmbar ist. Die Tiere saugen den Saft einzelner Zellen aus, sind also keine Phloemsauger.
Schadbild
Kennzeichnend für Befall mit Napfschildläusen ist die extrem starke Honigtaubildung mit daraus folgender Besiedlung durch Schwärzepilze (Rußtau). Besiedelte Blüten welken vorzeitig. Bei der Nahrungsaufnahme von Deckelschildläusen wird giftiger Speichel abgesondert, an den Saugstellen bilden sich gelbe bis rötlich braune Flecken. Bei starkem Befall kommt es auch zu Wachstumsstockungen, seltener zu Deformationen.
Bekämpfung
Der chemische Pflanzenschutz muss konsequent und wiederholt durchgeführt werden. Bei Befall sind mindestens 2-3 Behandlungen im Abstand von 2 Wochen mit Imidacloprid, Methamidophos oder Dimethoat notwendig. Pirimiphosmethyl darf in einigen Ländern wie Deutschland nicht in Gewächshäusern angewandt werden. Mineralöl wirkt zwar recht zuverlässig, ist bei häufigem Einsatz allerdings problematisch was die Verträglichkeit verschiedener Orchideen angeht. Bei chemischen Pflanzenschutzmaßnahmen ist auf ständigen Wirkstoffgruppenwechsel zu achten.
Biologischer Pflanzenschutz
Die biologische Bekämpfung von Schildläusen in Orchideenkulturen ist möglich, allerdings muss aufgrund der Spezialisierung mancher Nützlinge die genaue Diagnose der auftretenden Art erfolgen. Bei festgestelltem Befall mit Deckelschildläusen ist keine Differentialdiagnose notwendig. Die kommerziell vertriebenen Nützlinge unterscheiden nicht und nehmen alle Arten gleich gut an. Einsetzbar sind die Schlupfwespe Aphytis melinus sowie verschiedene Marienkäfer.
Bei Befall mit Napfschildläusen muss die auftretende Art bestimmt werden. Gegen Coccus hesperidum können die Schlupfwespen Microterys flavus, Metaphycus helvolus und Encyrtus lecaniorum recht erfolgreich eingesetzt werden. Sind Saissetia-Arten vorhanden, kann neben Metaphycus und Encyrtus auch die Schlupfwespe Coccophagus lycimnia frei gelassen werden.
Bei Befall mit Napfschildläusen muss die auftretende Art bestimmt werden. Gegen Coccus hesperidum können die Schlupfwespen Microterys flavus, Metaphycus helvolus und Encyrtus lecaniorum recht erfolgreich eingesetzt werden. Sind Saissetia-Arten vorhanden, kann neben Metaphycus und Encyrtus auch die Schlupfwespe Coccophagus lycimnia frei gelassen werden.
Schmetterlinge
Biologie
Schmetterlinge (Lepidoptera)
Zünsler (Duponchelia fovealis Zeller)
Geflammter Rebenwickler (Clepsis spectrana Treit.)
Der Problemschädling Duponchelia aus der Familie der Zünsler tritt seit einiger Zeit auch in Orchideenbeständen auf. Der Schadschmetterling stammt ursprünglich aus Südeuropa, er ist vorwiegend in Kalthauskulturen sowie in gekühlten Phalaenopsis zu finden. Der Falter ist ca. 19-21 mm lang, braun bis braunschwarz gefärbt mit helleren Ringen am Hinterleib. Typisch ist der lange, nach oben gebogene Hinterleib. Die Tiere sitzen meist unter den Blättern und fliegen bei Störung schnell auf. Die Raupen sind 2-3 cm lang, Grundfarbe ist weiß mit vielen kleinen, braunen Punkten. Der Kopf ist dunkel. Die Raupen fressen sehr versteckt, meist an der Substratoberfläche oder in der obersten Bodenschicht. Dort sind dann auch feine Gespinste zu erkennen unter denen die Tiere geschützt sind und sich später auch verpuppen.
Die Entwicklung unter Gewächshausbedingungen dauert vom Ei bis zum erwachsenen Tier etwa 6-8 Wochen, wobei das fraßaktive Larvenstadium mit 3-4 Wochen den größten Teil einnimmt. Clepsis spectrana ist ein in Mitteleuropa lebender Wickler der häufig in Gewächshäusern vorkommt. Der Falter ist etwa 15-24 mm groß, ockerfarben bis gelblich mit dunklen Flecken. Die Raupen sind 20-25 mm lang, braun bis olivgrün, der Kopf ist schwarz.
Zünsler (Duponchelia fovealis Zeller)
Geflammter Rebenwickler (Clepsis spectrana Treit.)
Der Problemschädling Duponchelia aus der Familie der Zünsler tritt seit einiger Zeit auch in Orchideenbeständen auf. Der Schadschmetterling stammt ursprünglich aus Südeuropa, er ist vorwiegend in Kalthauskulturen sowie in gekühlten Phalaenopsis zu finden. Der Falter ist ca. 19-21 mm lang, braun bis braunschwarz gefärbt mit helleren Ringen am Hinterleib. Typisch ist der lange, nach oben gebogene Hinterleib. Die Tiere sitzen meist unter den Blättern und fliegen bei Störung schnell auf. Die Raupen sind 2-3 cm lang, Grundfarbe ist weiß mit vielen kleinen, braunen Punkten. Der Kopf ist dunkel. Die Raupen fressen sehr versteckt, meist an der Substratoberfläche oder in der obersten Bodenschicht. Dort sind dann auch feine Gespinste zu erkennen unter denen die Tiere geschützt sind und sich später auch verpuppen.
Die Entwicklung unter Gewächshausbedingungen dauert vom Ei bis zum erwachsenen Tier etwa 6-8 Wochen, wobei das fraßaktive Larvenstadium mit 3-4 Wochen den größten Teil einnimmt. Clepsis spectrana ist ein in Mitteleuropa lebender Wickler der häufig in Gewächshäusern vorkommt. Der Falter ist etwa 15-24 mm groß, ockerfarben bis gelblich mit dunklen Flecken. Die Raupen sind 20-25 mm lang, braun bis olivgrün, der Kopf ist schwarz.
Schadbild
Durch Duponchelia können junge Blätter befressen sein. Auf der Substratoberfläche sind feine Gespinste sichtbar unter denen die Raupen fressen. Unter Umständen können sich die Larven in die Blattbasis einbohren. Clepsis spectrana tritt ab Juni zuweilen in Gewächshäusern auf. Die Raupen fressen unter kleinen Gespinsten an weicheren Pflanzenteilen, z.b. in den Blüten von Masdevallia.
Bekämpfung
Zur Befallskontrolle können UV-Lichtfallen in Gewächshäusern installiert werden, Gelbtafeln dagegen sind nicht so gut geeignet. Die Überwachung der Flugaktivität kann auch mit Pheromonen erfolgen. Chemische Behandlungen können mit Kontaktinsektiziden wie Thiacloprid, Azadirachtin, Spinosad durchgeführt werden. Aufgrund der versteckten Lebensweise müssen diese bis zur Befallsfreiheit in wiederholten Abständen erfolgen. Geeignet sind auch Wachstumsregulatoren wie Teflubenzuron, Diflubenzuron welche die Häutung der Larven verhindern.
Biologischer Pflanzenschutz
Möglichkeiten der biologischen Kontrolle bestehen mit Erzwespen (Trichogramma sp.). Die kleinen Schlupfwespen sind etwa 0,5-2 mm lang und parasitieren ausschließlich Eier von Schadschmetterlingen. Die parasitierten Eier verfärben sich schwarz, bereits kurze Zeit später schlüpfen die erwachsenen Schlupfwespen. In der leeren Schale des Eis bleibt ein gut sichtbares, kreisrundes Loch zurück. Die meisten Arten sind polyphag, bevorzugen aber bestimmte Wirte. Für die gärtnerische Praxis werden von einzelnen Nützlingsanbietern verschiedene Arten im Gemisch angeboten.
Hypoaspis-Raubmilben können gegen verschiedene im Boden lebende Schädlinge eingesetzt werden. Die Milben beißen die Eier kurz vor dem Schlupf der Larven auf. Insektenpathogene Nematoden (Steinernema sp.) sind ebenfalls zur biologischen Bekämpfung möglich. Bei wiederholter Applikation kann es innerhalb kurzer Zeit zu erheblicher Reduzierung der Larvenzahl kommen. Gute Ergebnisse als Insektenpathogene bieten Bakterien. Gegen Schadschmetterlinge wirksam sind Stämme von Bacillus thuringiensis (sog. B.t.-Präparate). Das Bakterium vermehrt sich in infizierten Insekten und bildet dort Dauersporen aus. Bei der Sporenbildung entstehen Eiweißkristalle (sog. Endotoxinkristalle).
Werden diese bakteriellen Produkte von empfindlichen Insekten gefressen, zerstören die Kristalle die Zellen der Darmwand. Es kommt zum Einringen in den Körper, die Insekten sterben innerhalb kurzer Zeit ab. B.t.-Präparate sind keine Kontaktmittel sondern reine Fraßgifte. Nach Aufnahme des Bakteriums tritt ein relativ schneller Fraßstopp der Larven ein. Je kleiner und jünger die Larven, desto schneller und besser wirken auch die eingesetzten B.t.-Präparate.
Hypoaspis-Raubmilben können gegen verschiedene im Boden lebende Schädlinge eingesetzt werden. Die Milben beißen die Eier kurz vor dem Schlupf der Larven auf. Insektenpathogene Nematoden (Steinernema sp.) sind ebenfalls zur biologischen Bekämpfung möglich. Bei wiederholter Applikation kann es innerhalb kurzer Zeit zu erheblicher Reduzierung der Larvenzahl kommen. Gute Ergebnisse als Insektenpathogene bieten Bakterien. Gegen Schadschmetterlinge wirksam sind Stämme von Bacillus thuringiensis (sog. B.t.-Präparate). Das Bakterium vermehrt sich in infizierten Insekten und bildet dort Dauersporen aus. Bei der Sporenbildung entstehen Eiweißkristalle (sog. Endotoxinkristalle).
Werden diese bakteriellen Produkte von empfindlichen Insekten gefressen, zerstören die Kristalle die Zellen der Darmwand. Es kommt zum Einringen in den Körper, die Insekten sterben innerhalb kurzer Zeit ab. B.t.-Präparate sind keine Kontaktmittel sondern reine Fraßgifte. Nach Aufnahme des Bakteriums tritt ein relativ schneller Fraßstopp der Larven ein. Je kleiner und jünger die Larven, desto schneller und besser wirken auch die eingesetzten B.t.-Präparate.
Schnecken
Biologie
Schnecken (Gastropoda) gehören zu den Weichtieren (Mollusca). Sie besitzen eine mit vielen Zähnchen besetzte chitinartige Reibeplatte, der sogenannten Radula, mit der sie ihre Nahrung von der Oberfläche her regelrecht abfräsen. Schnecken sind dämmerungs- oder nachtaktiv, sie leben tagsüber meist unter Rinde, Töpfen oder zwischen den Pflanzen. Alle Schnecken produzieren Schleim und sind in der Regel sehr polyphag. Die Eier werden im Substrat abgelegt. Aus den Eiern schlüpfen Jungtiere, die den Eltern sehr ähnlich sind.
An Orchideen treten sowohl Nacktschnecken ohne festes Gehäuse als auch Gehäuseschnecken mit mehr oder wenige großen Schalen auf. Manche Schneckenarten können eine wichtige Rolle als Überträger von Viren spielen. Häufigste Art unter den Nacktschnecken ist die Genetzte Ackerschnecke (Deroceras reticulatum Müller). Diese Art kann unter günstigen Bedingungen 50-60 mm lang werden, der Körper ist grau bis rötlichbraun mit dunklen, netzartigen Linien und Flecken. Die Eier mit einem Durchmesser bis 2 mm werden in Häufchen von 4-10 Stück bevorzugt an die Unterseite von Töpfen, Holz oder Rinde abgelegt. Die Art zeichnet sich durch große Vermehrungsfähigkeit aus, unter den günstigen klimatischen Bedingungen in Gewächshäusern können erwachsene Ackerschnecken jeden 2. oder 3. Tag Eier legen. Die Tiere fressen besonders an oberirdischen Pflanzenteilen. Sie bevorzugen junges, weiches Pflanzengewebe und sind deswegen häufig an Jungpflanzen sowie auf Blüten zu finden.
Unter den Gehäuseschnecken ist die Kleine Gewächshausglanzschnecke (Zonitoides arboreus Say) von Bedeutung. Es handelt sich um eine nordamerikanische Art. Das Gehäuse ist ca. 2-2,5 mm hoch und 3,5-4 mm breit, braungelb bis rotbraun gefärbt. Die Nahrung besteht sowohl aus verrottendem als auch lebendem Pflanzenmaterial, wobei letzteres eindeutig bevorzugt wird. Diese Art liebt Rindensubstrate und findet dort ideale Lebensbedingungen vor. Die gesamte Entwicklungsdauer verläuft in etwa 3 Monaten.
Gehäuseschnecken treten meist an Wurzeln sowie am Wurzelhals auf, machen zwar nur geringen direkten Schaden, schaffen aber Wunden. Diese sind dann wiederum Eintrittspforten für Schadpilze. Meist erfolgt ihre Einschleppung mit dem Pflanzsubstrat, vor allem mit Rinde und Kokosfasern.
Weitere Schneckenarten in Gewächshäusern die vereinzelt auch an Orchideen fressen sind Opeas pumilum Pfeiffer, Oxychilus draparnaudi Beck, Discus rotundatus Müller sowie Lehmannia marginata Müller. Viele Schnecken werden mit Pflanzenmaterial und besonders mit anhaftenden Substraten aus tropischen Ländern eingeschleppt.
An Orchideen treten sowohl Nacktschnecken ohne festes Gehäuse als auch Gehäuseschnecken mit mehr oder wenige großen Schalen auf. Manche Schneckenarten können eine wichtige Rolle als Überträger von Viren spielen. Häufigste Art unter den Nacktschnecken ist die Genetzte Ackerschnecke (Deroceras reticulatum Müller). Diese Art kann unter günstigen Bedingungen 50-60 mm lang werden, der Körper ist grau bis rötlichbraun mit dunklen, netzartigen Linien und Flecken. Die Eier mit einem Durchmesser bis 2 mm werden in Häufchen von 4-10 Stück bevorzugt an die Unterseite von Töpfen, Holz oder Rinde abgelegt. Die Art zeichnet sich durch große Vermehrungsfähigkeit aus, unter den günstigen klimatischen Bedingungen in Gewächshäusern können erwachsene Ackerschnecken jeden 2. oder 3. Tag Eier legen. Die Tiere fressen besonders an oberirdischen Pflanzenteilen. Sie bevorzugen junges, weiches Pflanzengewebe und sind deswegen häufig an Jungpflanzen sowie auf Blüten zu finden.
Unter den Gehäuseschnecken ist die Kleine Gewächshausglanzschnecke (Zonitoides arboreus Say) von Bedeutung. Es handelt sich um eine nordamerikanische Art. Das Gehäuse ist ca. 2-2,5 mm hoch und 3,5-4 mm breit, braungelb bis rotbraun gefärbt. Die Nahrung besteht sowohl aus verrottendem als auch lebendem Pflanzenmaterial, wobei letzteres eindeutig bevorzugt wird. Diese Art liebt Rindensubstrate und findet dort ideale Lebensbedingungen vor. Die gesamte Entwicklungsdauer verläuft in etwa 3 Monaten.
Gehäuseschnecken treten meist an Wurzeln sowie am Wurzelhals auf, machen zwar nur geringen direkten Schaden, schaffen aber Wunden. Diese sind dann wiederum Eintrittspforten für Schadpilze. Meist erfolgt ihre Einschleppung mit dem Pflanzsubstrat, vor allem mit Rinde und Kokosfasern.
Weitere Schneckenarten in Gewächshäusern die vereinzelt auch an Orchideen fressen sind Opeas pumilum Pfeiffer, Oxychilus draparnaudi Beck, Discus rotundatus Müller sowie Lehmannia marginata Müller. Viele Schnecken werden mit Pflanzenmaterial und besonders mit anhaftenden Substraten aus tropischen Ländern eingeschleppt.
Schadbild
Schnecken verursachen oberflächlich mit ihrer Raspelzunge zunächst Schabefraß an Wurzelspitzen, Bulben und Pseudobulben, Blättern und Blütenknospen. Bei weiterer Fraßaktivität entstehen kleine Löcher. An größeren, dickeren Blättern wird fast ausschließlich die Unterseite befressen. Diese Fraßstellen können später vernarben und mit weiterem Wachstum der Pflanzen bilden sich dort zuweilen deutliche, flächige Verkorkungen.
Die Wurzeln sind häufig in der Nähe der Wurzelspitze grubig angefressen. Durch die Fraßtätigkeit an Wurzeln entstehen Wunden, was wiederum häufig zu Sekundärbefall mit Schwächeparasiten führt. Die Blüten werden besonders bei Cattleya und Phaius befressen. Ein weiteres Merkmal für Schneckenbefall sind die mitunter kräftigen Schleimspuren sowie unregelmäßig aussehende, schwarze Kotflecken an den Fraßstellen.
Die Wurzeln sind häufig in der Nähe der Wurzelspitze grubig angefressen. Durch die Fraßtätigkeit an Wurzeln entstehen Wunden, was wiederum häufig zu Sekundärbefall mit Schwächeparasiten führt. Die Blüten werden besonders bei Cattleya und Phaius befressen. Ein weiteres Merkmal für Schneckenbefall sind die mitunter kräftigen Schleimspuren sowie unregelmäßig aussehende, schwarze Kotflecken an den Fraßstellen.
Bekämpfung
Im Zierpflanzenbau stehen drei Wirkstoffe in Formulierung als Schneckenkorn zur Verfügung: Methiocarb, Metaldehyd und Eisen-III-Phosphat. Metaldehydhaltige Produkte wirken bei Temperaturen ab 20 °C und zeichnen sich durch längere Wirkungsdauer aus. Bei Behandlungen mit den Präparaten können sich Schnecken bei nicht letaler Wirkstoffaufnahme und entsprechend hoher Luftfeuchtigkeit in Gewächshäusern allerdings wieder erholen, deshalb sind mehrmalige Nachbehandlungen notwendig. Schnecken, die den Wirkstoff aufgenommen haben, bilden große Mengen an Schleim aus.
In feuchten Biotopen ist die Wirkung von Methiocarb besser als die von Metaldehyd. Methiocarb hat auch ovizide Wirkung, ist schon bei niedrigeren Temperaturen wirksam, hat aber auch eine geringere Wirkungsdauer. Schnecken bleiben nach Aufnahme des Wirkstoffes noch einige Zeit aktiv. Zur Wirkungsverbesserung muss Wasser vorhanden sein, bei Trockenheit kann sich eine Schnecke sonst wieder erholen. Es erfolgt im Gegensatz zur Aufnahme von Metaldehyd keine Schleimproduktion.
Bei Aufnahme von Eisen-III-Phosphat soll meist ein sofortiger Fraßstopp stattfinden. Durch den Abbau des Wirkstoffs in Eisen und Phosphor entstehen keine umweltschädigenden Rückstände. Die Wirksamkeit beruht nicht auf Wasserentzug, es kommt zu keiner Beeinträchtigung bei feuchter Witterung. Es erfolgt ebenfalls keine Schleimproduktion.
Die meisten Produkte lassen unter hohen Luftfeuchtebedingungen, wie sie in Gewächshäusern direkt im Pflanzenbestand üblich sind, relativ schnell in der Wirkung nach. Um dem entgegen zu wirken, müssen Behandlungen in regelmäßigen Abständen von mindestens 3-4 Wochen, besser aber im Abstand von etwa 10 Tagen wiederholt werden. Und zwar solange bis keine neuen Fraßschäden mehr erkennbar sind. Zur Wirkungsverbesserung hat sich in der gärtnerischen Praxis das Streuen aus Kombinationen verschiedener Wirkstoffe bewährt.
Schwierigkeiten macht die Bekämpfung der meist versteckt im und auf dem Substrat lebenden, kleinen Gehäuseschnecken. Gießbehandlungen mit Methiocarb oder anderen Carbamaten können die Population dieser Arten unter günstigen Umständen deutlich reduzieren. Der Aufwand ist allerdings sehr hoch, da mit großen Wassermengen gearbeitet werden muss.
In feuchten Biotopen ist die Wirkung von Methiocarb besser als die von Metaldehyd. Methiocarb hat auch ovizide Wirkung, ist schon bei niedrigeren Temperaturen wirksam, hat aber auch eine geringere Wirkungsdauer. Schnecken bleiben nach Aufnahme des Wirkstoffes noch einige Zeit aktiv. Zur Wirkungsverbesserung muss Wasser vorhanden sein, bei Trockenheit kann sich eine Schnecke sonst wieder erholen. Es erfolgt im Gegensatz zur Aufnahme von Metaldehyd keine Schleimproduktion.
Bei Aufnahme von Eisen-III-Phosphat soll meist ein sofortiger Fraßstopp stattfinden. Durch den Abbau des Wirkstoffs in Eisen und Phosphor entstehen keine umweltschädigenden Rückstände. Die Wirksamkeit beruht nicht auf Wasserentzug, es kommt zu keiner Beeinträchtigung bei feuchter Witterung. Es erfolgt ebenfalls keine Schleimproduktion.
Die meisten Produkte lassen unter hohen Luftfeuchtebedingungen, wie sie in Gewächshäusern direkt im Pflanzenbestand üblich sind, relativ schnell in der Wirkung nach. Um dem entgegen zu wirken, müssen Behandlungen in regelmäßigen Abständen von mindestens 3-4 Wochen, besser aber im Abstand von etwa 10 Tagen wiederholt werden. Und zwar solange bis keine neuen Fraßschäden mehr erkennbar sind. Zur Wirkungsverbesserung hat sich in der gärtnerischen Praxis das Streuen aus Kombinationen verschiedener Wirkstoffe bewährt.
Schwierigkeiten macht die Bekämpfung der meist versteckt im und auf dem Substrat lebenden, kleinen Gehäuseschnecken. Gießbehandlungen mit Methiocarb oder anderen Carbamaten können die Population dieser Arten unter günstigen Umständen deutlich reduzieren. Der Aufwand ist allerdings sehr hoch, da mit großen Wassermengen gearbeitet werden muss.
Spinnmilben
Biologie
Die an Phalaenopsis vorkommende Gemeine Spinnmilbe (Tetranychus urticae Koch) ist etwa 0,5 mm lang, dabei gelb, rot bis grün gefärbt mit zwei dunklen Flecken auf dem Rücken. Der Schädling wird auch Rote Spinne genannt, was auf die durch klimatische Einflüsse im Herbst ausgelöste Farbausprägung der Winterweibchen zurückgeht. Die Entwicklungsdauer vom Ei über sechsbeinige Larvenstadien bis zum achtbeinigen, erwachsenen Tier ist stark von der Temperatur und der Luftfeuchtigkeit abhängig und verläuft innerhalb 10 bis 20 Tagen.
Spinnmilben haben bei hohen Temperaturen um 27 °C und geringer Luftfeuchtigkeit optimale Vermehrungsbedingungen. Während der Lebensdauer von etwa 4-5 Wochen legen die Weibchen ihre Eier vorwiegend an die Unterseite der Blätter. Bei stärkerem Befall bilden die Tiere fädige Gespinste aus. Auch Knospen und Blüten werden von Spinnmilben befallen. Besonders in den Sommermonaten kann es zu explosionsartiger Zunahme der Spinnmilben kommen.
Spinnmilben haben bei hohen Temperaturen um 27 °C und geringer Luftfeuchtigkeit optimale Vermehrungsbedingungen. Während der Lebensdauer von etwa 4-5 Wochen legen die Weibchen ihre Eier vorwiegend an die Unterseite der Blätter. Bei stärkerem Befall bilden die Tiere fädige Gespinste aus. Auch Knospen und Blüten werden von Spinnmilben befallen. Besonders in den Sommermonaten kann es zu explosionsartiger Zunahme der Spinnmilben kommen.
Schadbild
Spinnmilben saugen einzelne Zellen leer in die daraufhin Luft eindringt. Blätter sind deshalb zunächst stellenweise silbrig aufgehellt, oft weißlich gesprenkelt. Bei zunehmendem Befall fließen die Flecken zusammen, die Blätter werden fahl gelb und vertrocknen schließlich. Meist an Blattunterseiten befinden sich feine, helle Gespinste, dazwischen mit der Lupe erkennbare Eier und Häutungsreste.
Bekämpfung
Zur Befallsvermeidung darf die relative Luftfeuchte nicht unter 60 % fallen. Chemische Behandlungen sind schwierig, Spinnmilben bilden relativ schnell Resistenzen aus. Zur Vermeidung ist unbedingt ein Wechsel der Wirkstoffgruppen einzuhalten. Beispielsweise haben Tebufenpyrad, Fenpyroximat und Fenazaquin das gleiche Wirkungsprinzip und dürfen zur Resistenzvermeidung nur einmal während der Entwicklung der Spinnmilbenpopulation eingesetzt werden. Das gleiche gilt beim Einsatz von Clofentezin und Hexythiazox, diese beiden Präparate wirken gegen Eier und junge Larvenstadien. Abamectin hat eine schnelle Anfangswirkung, aber nur eine geringe Dauerwirkung von 7-10 Tagen. Die Wirkung von Spirodiclofen dagegen wird erst nach 1-2 Wochen sichtbar, hält dafür aber auch über einen wesentlich längeren Zeitraum an.
Biologischer Pflanzenschutz
Biologische Bekämpfung ist möglich mit Raubmilben der Art Phytoseiulus persimilis Athias-Henriot. Die erwachsenen Tiere saugen Eier und Larven der Spinnmilben aus. Bei Temperaturen zwischen 17 °C und 25 °C und einer relativen Luftfeuchtigkeit von 75 % haben die Raubmilben ideale Vermehrungsbedingungen und entwickeln sich besser als Spinnmilben.
Bei Auftreten der ersten Spinnmilben werden Phytoseiulus in den Befallsherden verteilt. Bei leichtem Befall im Abstand von 14 Tagen 5 Tiere je m² ausbringen, in Befallsherden möglicherweise auch bis zu 30 Tiere je m² notwendig. Integrierbare chemische Maßnahmen können mit Azadirachtin durchgeführt werden. Bei Spritzungen mit Fenazaquin oder Abamectin werden Raubmilben stark geschädigt, können aber nach etwa 14 Tagen wieder ausgesetzt werden.
Bei Auftreten der ersten Spinnmilben werden Phytoseiulus in den Befallsherden verteilt. Bei leichtem Befall im Abstand von 14 Tagen 5 Tiere je m² ausbringen, in Befallsherden möglicherweise auch bis zu 30 Tiere je m² notwendig. Integrierbare chemische Maßnahmen können mit Azadirachtin durchgeführt werden. Bei Spritzungen mit Fenazaquin oder Abamectin werden Raubmilben stark geschädigt, können aber nach etwa 14 Tagen wieder ausgesetzt werden.
Springschwänze
Biologie
Springschwänze gehören zu den Urinsekten, sind aber immer flügellos. Die 1-4 mm kleinen Tierchen haben eine weißliche, manchmal silbrig- schwarze Körperfärbung. Charakteristisch ist die sogenannte Sprunggabel am Hinterleib, die den Tieren ihre Fähigkeit zum Springen gibt. Springschwänze sind an feuchte Biotope gebunden, weshalb Sphagnumhaltige Substrate oder Torfe bevorzugt werden.
Die Nahrung besteht überwiegend aus totem organischem Material, bei Massenauftreten, besonders in zu feuchten bis nassen Topferden, können allerdings auch sehr junge, lebende Pflanzenteile angefressen werden. Die Eiablage erfolgt in den Boden, die daraus schlüpfenden Larven unterscheiden sich nur geringfügig von den Adulten. An die Temperaturen stellen Springschwänze keinen großen Ansprüche, auch in Kalthäusern von 10 °C bis 16 °C findet Vermehrung statt.
Die Nahrung besteht überwiegend aus totem organischem Material, bei Massenauftreten, besonders in zu feuchten bis nassen Topferden, können allerdings auch sehr junge, lebende Pflanzenteile angefressen werden. Die Eiablage erfolgt in den Boden, die daraus schlüpfenden Larven unterscheiden sich nur geringfügig von den Adulten. An die Temperaturen stellen Springschwänze keinen großen Ansprüche, auch in Kalthäusern von 10 °C bis 16 °C findet Vermehrung statt.
Schadbild
Wurzelspitzen oder sehr junge, weiche Pflanzen können angefressen sein, es entsteht ein feiner Loch- und Schabefraß. Bei entsprechender Feuchtigkeit sind dann massenhaft die kleinen, weißlichen Tierchen auf der Substratoberfläche sichtbar. An Orchideen ist das Schadpotential durch Springschwänze allerdings als sehr gering einzuschätzen.
Bekämpfung
Eine Bekämpfung von Springschwänzen ist in der Regel nicht notwendig, da die Tiere nur bei nassen Substraten zur Massenvermehrung neigen. Die chemische Bekämpfung kann mit Carbofuran erfolgen.
Biologischer Pflanzenschutz
Gegen die Larven der Schädlinge kann mit insektenpathogenen Nematoden (Steinernema feltiae Filipjev) gegossen werden. Dadurch wird die Population erheblich reduziert. Gute Möglichkeiten liegen auch mit dem Einsatz von Raubmilben (Hypoaspis miles Berl., H. aculeifer Can.) vor.
Die bodenbewohnenden Nützlinge ernähren sich polyphag von vielen Bodenschädlingen und können sich in Gewächshäusern gut etablieren. Springschwänze gehören dabei zu den bevorzugten Beutetieren. Da sich der Lebenszyklus von Hypoaspis aculeifer und Springschwänzen sehr ähnlich sind, sind die Raubmilben besonders gut gegen diesen Schädling geeignet.
Die bodenbewohnenden Nützlinge ernähren sich polyphag von vielen Bodenschädlingen und können sich in Gewächshäusern gut etablieren. Springschwänze gehören dabei zu den bevorzugten Beutetieren. Da sich der Lebenszyklus von Hypoaspis aculeifer und Springschwänzen sehr ähnlich sind, sind die Raubmilben besonders gut gegen diesen Schädling geeignet.
Tausendfüßer
Biologie
Vertreter aus der Klasse der Myriapoda werden in zwei Unterklassen geteilt. Erstes die Doppelfüßer oder auch Tausendfüßer im engeren Sinne (Diplopoda) und zweitens die Zwergfüßer (Symphyla).
Doppelfüßer sind langgestreckte bis asselförmige Tiere deren Außenskelett durch Kalkeinlagerungen sehr hart ist. Die Beine liegen sämtlich auf der Bauchseite und sind charakteristisch angeordnet. Das erste und das letzte Körpersegment tragen keine Beine, das zweite bis vierte nur je ein Beinpaar und die übrigen Segmente je zwei Beinpaare (daher der Name Doppelfüßer). Die Larven haben nur sechs Beinpaare. Eier werden ins Substrat gelegt, während des Entwicklungszyklus von einigen Wochen werden mehrere Stadien durchlaufen. Die Tiere rollen sich oft zusammen, ein weiteres typisches Erkennungsmerkmal. Doppelfüßer benötigen eine hohe relative Luftfeuchte, sind nachtaktiv und halten sich tagsüber unter Töpfen, im Substrat und ähnlichen Stellen versteckt, sie halten sich vorwiegend im Boden auf und sind als Humusbildner von Bedeutung. Die Nahrung besteht überwiegend aus organischem Material, sie nehmen nur selten lebendes Pflanzenmaterial an, grüne Pflanzenteile werden nicht gefressen.
Ein wichtiger in Gewächshäusern vorkommender Doppelfüßer ist der Getüpfelte Tausendfuß (Blaniulus guttulatus Bosc.). Die Tiere sind schlank, weiß bis gräulich gefärbt und etwa 10-18 mm lang, sie leben im Boden und rollen sich bei Beunruhigung spiralig zusammen. Die Art lebt polyphag an Wurzeln. Weniger häufig an Orchideen auftretend ist der aus tropischen Regionen stammende Gewächshaustausendfuß (Orthomorpha gracilis Koch). Das Tier ist etwa 16-23 mm lang, dunkelbraun bis schwarz gefärbt mit 20 Körpersegmenten versehen.
Zwergfüßer sind kleine, weißliche Tiere mit nur einem Beinpaar je Körpersegment. Am Hinterende befinden sich charakteristische Spinngriffel, am Kopf eine vielgliedrige Antenne. Im Gegensatz zu den Doppelfüßern besitzen die nur wenige mm langen Tiere keine Kalkeinlagerungen. In Gewächshäusern kann der Gewächshauszwergfüßer (Scutigerella immaculata Newp. = Scolopendrella immaculata Newp.) schädigend werden. Das etwa 6 mm lange Tierchen mit sehr hohem Feuchtigkeitsbedarf ist in humosen Substraten weit verbreitet. Besonders in torfhaltiger Pflanzerde kann es zur Bildung größerer Kolonien kommen.
Doppelfüßer sind langgestreckte bis asselförmige Tiere deren Außenskelett durch Kalkeinlagerungen sehr hart ist. Die Beine liegen sämtlich auf der Bauchseite und sind charakteristisch angeordnet. Das erste und das letzte Körpersegment tragen keine Beine, das zweite bis vierte nur je ein Beinpaar und die übrigen Segmente je zwei Beinpaare (daher der Name Doppelfüßer). Die Larven haben nur sechs Beinpaare. Eier werden ins Substrat gelegt, während des Entwicklungszyklus von einigen Wochen werden mehrere Stadien durchlaufen. Die Tiere rollen sich oft zusammen, ein weiteres typisches Erkennungsmerkmal. Doppelfüßer benötigen eine hohe relative Luftfeuchte, sind nachtaktiv und halten sich tagsüber unter Töpfen, im Substrat und ähnlichen Stellen versteckt, sie halten sich vorwiegend im Boden auf und sind als Humusbildner von Bedeutung. Die Nahrung besteht überwiegend aus organischem Material, sie nehmen nur selten lebendes Pflanzenmaterial an, grüne Pflanzenteile werden nicht gefressen.
Ein wichtiger in Gewächshäusern vorkommender Doppelfüßer ist der Getüpfelte Tausendfuß (Blaniulus guttulatus Bosc.). Die Tiere sind schlank, weiß bis gräulich gefärbt und etwa 10-18 mm lang, sie leben im Boden und rollen sich bei Beunruhigung spiralig zusammen. Die Art lebt polyphag an Wurzeln. Weniger häufig an Orchideen auftretend ist der aus tropischen Regionen stammende Gewächshaustausendfuß (Orthomorpha gracilis Koch). Das Tier ist etwa 16-23 mm lang, dunkelbraun bis schwarz gefärbt mit 20 Körpersegmenten versehen.
Zwergfüßer sind kleine, weißliche Tiere mit nur einem Beinpaar je Körpersegment. Am Hinterende befinden sich charakteristische Spinngriffel, am Kopf eine vielgliedrige Antenne. Im Gegensatz zu den Doppelfüßern besitzen die nur wenige mm langen Tiere keine Kalkeinlagerungen. In Gewächshäusern kann der Gewächshauszwergfüßer (Scutigerella immaculata Newp. = Scolopendrella immaculata Newp.) schädigend werden. Das etwa 6 mm lange Tierchen mit sehr hohem Feuchtigkeitsbedarf ist in humosen Substraten weit verbreitet. Besonders in torfhaltiger Pflanzerde kann es zur Bildung größerer Kolonien kommen.
Schadbild
Junge Pflanzenteile an der Substratoberfläche sowie Wurzelspitzen können in Ausnahmefällen angenagt werden. Der Getüpfelte Tausendfuß nagt unter Umständen den Wurzelhals von Jungpflanzen durch oder bohrt Löcher in die Wurzeln. In Verbindung mit Substratvernässung kann es zu erheblichen Schäden durch pathogene Bodenpilze kommen. Zwergfüßer können bei Massenauftreten zum Teil starke Schäden an jungen Wurzeln und Trieben verursachen.
Doppel- und Zwergfüßer zerstören bei stärkerem Befall durch ihre Humusbildung außerdem die Struktur der Substrate, es kommt zu einer Verdichtung im unteren Teil der Topferde.
Bekämpfung
Die Verwendung sauberer, strukturstabiler Substrate beugt einem Befall vor. Einschleppung mit Substraten oder Jungpflanzen ist möglich, evtl. müssen Substrate gedämpft werden. Direkte Bekämpfung mit chemischen Präparaten kann durch prophylaktisches Einmischen von Carbofuran in Substrate erfolgen. Bei Befall wirken Methiocarbhaltige Ködermittel, die auch gegen Schnecken eingesetzt werden.
Biologischer Pflanzenschutz
Nach ersten Erfahrungen kann gegen die Larven der Schädlinge auch mit insektenpathogenen Nematoden (Steinernema feltiae Filipjev) gegossen werden. In Versuchen war der Schädlingsbesatz gegenüber der Kontrolle in den ersten 2-3 Wochen um 50-70 % reduziert.
Gute Möglichkeiten für den biologischen Pflanzenschutz bietet auch der Einsatz von Raubmilben (Hypoaspis miles Berl., H. aculeifer Can.). Die bodenbewohnenden Nützlinge ernähren sich polyphag von vielen Bodenschädlingen und können sich in Gewächshäusern gut etablieren. Gegen Zwergfüßer sind Aufwandmengen von 50-100 Tieren je m² auszustreuen.
Gute Möglichkeiten für den biologischen Pflanzenschutz bietet auch der Einsatz von Raubmilben (Hypoaspis miles Berl., H. aculeifer Can.). Die bodenbewohnenden Nützlinge ernähren sich polyphag von vielen Bodenschädlingen und können sich in Gewächshäusern gut etablieren. Gegen Zwergfüßer sind Aufwandmengen von 50-100 Tieren je m² auszustreuen.
Thrips
Biologie
Thripse, Fransenflügler, Blasenfüße (Thysanoptera), sind kleine, meist nur 1-2 mm lange, schlank gebaute Insekten mit zwei Paar gefransten Flügeln. Für die Artbestimmung wichtig ist deren Gestalt und die Beborstung. Am Beinende befinden sich Tarsen mit kleinen Krallen und den namengebenden Haftblasen. Die Insekten besitzen stechend-saugende Mundwerkzeuge, beim Einstich in das Zellgewebe wird der Zellinhalt aufgezogen. In die Zellen dringt Luft ein, sie erscheinen deshalb silbrig-glänzend. Thripse sind größtenteils Pflanzensauger, es gibt aber auch einige räuberische Arten.
Die pflanzenschädigenden Thripse legen ihre Eier mit einem Legebohrer in Blätter oder andere Pflanzenteile. Die Entwicklung verläuft über zwei flügellose Larvenstadien bis zum erwachsenen Tier. Dazwischen liegen zwei bis drei Nymphenstadien, die schon die sogenannten Stummelflügel besitzen. Die ersten Larvenstadien und die Adulten sind sehr beweglich, während die Nymphen zum Teil in unbewegliche Ruhephasen gehen. Die Dauer der Entwicklung ist stark temperatur- und lichtabhängig. Unter gleichmäßig günstigen Gewächshausbedingungen kann je nach Art mit 10-12 Generationen im Jahr gerechnet werden.
An Orchideen können verschiedene Arten schädigend werden:
Kalifornischer Blütenthrips ( Frankliniella occidentalis Pergande): Häufigste Art in Gewächshäusern, sehr polyphag. Die Adulten sind etwa 2 mm lang, hellgelb bis braungelb gefärbt, die Larve ist meist goldgelb. Der Entwicklungszyklus umfasst zwei Larven- und zwei Nymphenstadien. Bei einer Temperatur von 20 °C bis 30 °C dauert er ungefähr 2-3 Wochen. Die Art lebt meist in Blüten, ist aber auch in der Lage an Blättern einen sprunghaften Populationsaufbau zu betreiben, in dessen Folge starke Schädigungen an allen oberirdischen Pflanzenteilen auftreten können. Die Thripsart ist Überträger des an Phalaenopsis vereinzelt vorkommenden Tomatenbronzeflecken-Virus. Gegen Insektizide können relativ schnell Resistenzen aufgebaut werden.
Zwiebel- oder Tabakthrips ( Thrips tabaci Lind.): Sehr polyphage, häufig vorkommende Art, Gewächshäuser werden häufig aus dem Freiland besiedelt. Die erwachsenen Tiere sind 1-1,3 mm lang, graugelb bis braun, teilweise fast schwarz gefärbt, die Larven weißlich bis gelb.
Die pflanzenschädigenden Thripse legen ihre Eier mit einem Legebohrer in Blätter oder andere Pflanzenteile. Die Entwicklung verläuft über zwei flügellose Larvenstadien bis zum erwachsenen Tier. Dazwischen liegen zwei bis drei Nymphenstadien, die schon die sogenannten Stummelflügel besitzen. Die ersten Larvenstadien und die Adulten sind sehr beweglich, während die Nymphen zum Teil in unbewegliche Ruhephasen gehen. Die Dauer der Entwicklung ist stark temperatur- und lichtabhängig. Unter gleichmäßig günstigen Gewächshausbedingungen kann je nach Art mit 10-12 Generationen im Jahr gerechnet werden.
An Orchideen können verschiedene Arten schädigend werden:
Kalifornischer Blütenthrips ( Frankliniella occidentalis Pergande): Häufigste Art in Gewächshäusern, sehr polyphag. Die Adulten sind etwa 2 mm lang, hellgelb bis braungelb gefärbt, die Larve ist meist goldgelb. Der Entwicklungszyklus umfasst zwei Larven- und zwei Nymphenstadien. Bei einer Temperatur von 20 °C bis 30 °C dauert er ungefähr 2-3 Wochen. Die Art lebt meist in Blüten, ist aber auch in der Lage an Blättern einen sprunghaften Populationsaufbau zu betreiben, in dessen Folge starke Schädigungen an allen oberirdischen Pflanzenteilen auftreten können. Die Thripsart ist Überträger des an Phalaenopsis vereinzelt vorkommenden Tomatenbronzeflecken-Virus. Gegen Insektizide können relativ schnell Resistenzen aufgebaut werden.
Zwiebel- oder Tabakthrips ( Thrips tabaci Lind.): Sehr polyphage, häufig vorkommende Art, Gewächshäuser werden häufig aus dem Freiland besiedelt. Die erwachsenen Tiere sind 1-1,3 mm lang, graugelb bis braun, teilweise fast schwarz gefärbt, die Larven weißlich bis gelb.
Schadbild
Durch Thripse geschädigte Pflanzen erscheinen aufgehellt, später verbräunt, meist in Verbindung mit kleinen schwarzen Kottröpfchen. Knospen werden in der Entwicklung gehemmt, fallen häufig frühzeitig ab. Triebe könne deformiert sein. Die Saugtätigkeit von Frankliniella und Thrips tabaci führt nicht sofort zu starken Deformationen und Wachstumsstockungen, wie sie bei vielen anderen Zierpflanzen zu beobachten sind. Es entstehen aber deutlich sichtbare Aufhellungen, weiße Flecken auf Blättern und Blüten mit Kotablagerungen. Bei stärkerem Befall können allerdings erhebliche Wuchsdeformationen auftreten.
Die Thripsart ist Überträger des an vereinzelt vorkommenden Tomatenbronzeflecken-Virus. Besonders gefährdet sind die Blüten vieler Orchideen-Arten, bevorzugt von Phalaenopsis, Miltonia, Cymbidium, Epidendrum, Cattleya und Epicattleya. Die Blattthripse Echinothrips, Parthenothrips und Heliothrips hinterlassen typische silbrig-glänzende Aufhellungen mit schwarzen Kottröpfchen. Bei starkem Befall kommt es zu Blattrandrollungen und Verbräunungen.
Die Thripsart ist Überträger des an vereinzelt vorkommenden Tomatenbronzeflecken-Virus. Besonders gefährdet sind die Blüten vieler Orchideen-Arten, bevorzugt von Phalaenopsis, Miltonia, Cymbidium, Epidendrum, Cattleya und Epicattleya. Die Blattthripse Echinothrips, Parthenothrips und Heliothrips hinterlassen typische silbrig-glänzende Aufhellungen mit schwarzen Kottröpfchen. Bei starkem Befall kommt es zu Blattrandrollungen und Verbräunungen.
Bekämpfung
Wichtigste Maßnahme zur Bekämpfung von Thripsen ist ein umfangreiches, kulturangepasstes Monitoring. Dazu gehören die Kontrolle aller zugekauften Pflanzen auf vorhandene Schadsymptome, Larven und Adulte, sowie die Befallskontrolle im Pflanzenbestand mit Blautafeln. Unter Tischen sollten keine Unkräuter stehen.
Bei der chemischen Bekämpfung von Frankliniella occidentalis und Thrips tabaci müssen Spritzungen mit Insektiziden im Abstand von 3-7 Tagen wiederholt durchgeführt werden. Sehr gute Ergebnisse werden mit Spinosad und Azadirachtin erzielt.
Echinothrips , Parthenothrips und Heliothrips sind sehr langsame Thripse, sie machen ihre gesamte Entwicklung auf den Blättern durch. Die chemische Bekämpfung mit Kontaktinsektiziden ist hier unproblematisch.
Bei der chemischen Bekämpfung von Frankliniella occidentalis und Thrips tabaci müssen Spritzungen mit Insektiziden im Abstand von 3-7 Tagen wiederholt durchgeführt werden. Sehr gute Ergebnisse werden mit Spinosad und Azadirachtin erzielt.
Echinothrips , Parthenothrips und Heliothrips sind sehr langsame Thripse, sie machen ihre gesamte Entwicklung auf den Blättern durch. Die chemische Bekämpfung mit Kontaktinsektiziden ist hier unproblematisch.
Biologischer Pflanzenschutz
Die biologische Bekämpfung gegen Frankliniella kann mit Raubmilben Amblyseius cucumeris Oud. durchgeführt werden. Da in Orchideen grundsätzlich mit Thripsen zu rechnen ist, haben obligatorische Freilassungen zu erfolgen. Die Raubmilben lassen sich in Orchideen nur schwer etablieren, eine Anwendung im Streuverfahren ist deshalb nicht zweckmäßig.
Erfolgversprechend ist die Ausbringung im Tütensystem. In den Tütchen befinden sich neben der Kleie als Trägerstoff auch Vorratsmilben (Tyrophagus sp.), von denen sich die Raubmilben ernähren. Sie sind daher als Zuchtstation zu verstehen, in denen genügend Futter zur Verfügung steht, welches die Grundlage für eine laufende Vermehrung der Raubmilben bildet. Das Tütensystem hat sich besonders bewährt, wenn Frankliniella schon im vegetativen Stadium der Pflanzen Populationsaufbau betreibt. Der Hintergrund ist das Phänomen der Fortpflanzungsfähigkeit von Amblyseius cucumeris Oud. wenn Frankliniella das alleinige Nahrungsangebot ausmacht. Da in grünen Pflanzen kein Blütenpollen oder sonstige Nahrung vorhanden ist, sind die Vorratsmilben in den Tüten eine gute Nahrungsergänzung, mit der dieser negative Effekt ausgeglichen werden kann.
Um stärkere Schwankungen in der Thripspopulation abzupuffern, können die integrierbaren Pflanzenschutzmittel Azadirachtin und Spinosad eingesetzt werden. Amblyseius wirkt nicht gegen Blattthripse, was die biologische Bekämpfung gegen diese Arten erheblich erschwert.
Erfolgversprechend ist die Ausbringung im Tütensystem. In den Tütchen befinden sich neben der Kleie als Trägerstoff auch Vorratsmilben (Tyrophagus sp.), von denen sich die Raubmilben ernähren. Sie sind daher als Zuchtstation zu verstehen, in denen genügend Futter zur Verfügung steht, welches die Grundlage für eine laufende Vermehrung der Raubmilben bildet. Das Tütensystem hat sich besonders bewährt, wenn Frankliniella schon im vegetativen Stadium der Pflanzen Populationsaufbau betreibt. Der Hintergrund ist das Phänomen der Fortpflanzungsfähigkeit von Amblyseius cucumeris Oud. wenn Frankliniella das alleinige Nahrungsangebot ausmacht. Da in grünen Pflanzen kein Blütenpollen oder sonstige Nahrung vorhanden ist, sind die Vorratsmilben in den Tüten eine gute Nahrungsergänzung, mit der dieser negative Effekt ausgeglichen werden kann.
Um stärkere Schwankungen in der Thripspopulation abzupuffern, können die integrierbaren Pflanzenschutzmittel Azadirachtin und Spinosad eingesetzt werden. Amblyseius wirkt nicht gegen Blattthripse, was die biologische Bekämpfung gegen diese Arten erheblich erschwert.
Trauermücken
Biologie
Trauermücken (Sciaridae oder Lycoriidae): Sciara sp., Bradysia sp. ,
Platthornmücken (Keroplatidae): Orfelia sp. , sind kleine, 4-6 mm lange, schwarze, feingliedrige Insekten. Die erwachsenen Tiere fliegen in zuckenden Bewegungen über der Substratoberfläche.
Die 4-7 mm langen Larven sind glasig, weißlich, schlank mit schwarzer Kopfkapsel. Sie leben in feuchten Substraten überwiegend von zerfallenden Pflanzenresten, können bei stärkerem Auftreten aber auch lebende Pflanzen schädigen. Häufig sind Trauermückenlarven in Verbindung mit Pilzbefall in den dicken Wurzeln von Phalaenopsis und Paphiopedilum zu finden. Geschwächte oder durch Schadpilze vorgeschädigte Pflanzen bieten eine große Attraktivität zur Eiablage. Die Larven werden häufig mit Sphagnum in die Kulturen eingeschleppt. Die Eier sind klein, oval, durchscheinend weißlich und werden in feuchte Substrate abgelegt. Die Entwicklung bis zum erwachsenen Tier dauert dann ungefähr 4 Wochen.
In Gewächshäusern treten überwiegend Arten von Sciara und Bradysia auf. Die Larven von Orfelia sind bedeutend größer und schlanker, in Wurzeln wurden 15-20 mm lange Exemplare gefunden. Die Adulten sind mit 8-10 mm ebenfalls viel größer als Trauermücken und unterscheiden sich auch deutlich im Habitus, der Hinterleib der Mücke ist beispielsweise horizontal gestreift. Die meisten Vertreter dieser Mückengattung leben weltweit in Pilzen, verpilzten Substraten, in Moosen oder unter der Rinde von Bäumen. Das lässt vermuten dass die Mücke durch Substratlieferungen mit Rinde und Sphagnum in Orchideenbetriebe verschleppt wurde.
Die 4-7 mm langen Larven sind glasig, weißlich, schlank mit schwarzer Kopfkapsel. Sie leben in feuchten Substraten überwiegend von zerfallenden Pflanzenresten, können bei stärkerem Auftreten aber auch lebende Pflanzen schädigen. Häufig sind Trauermückenlarven in Verbindung mit Pilzbefall in den dicken Wurzeln von Phalaenopsis und Paphiopedilum zu finden. Geschwächte oder durch Schadpilze vorgeschädigte Pflanzen bieten eine große Attraktivität zur Eiablage. Die Larven werden häufig mit Sphagnum in die Kulturen eingeschleppt. Die Eier sind klein, oval, durchscheinend weißlich und werden in feuchte Substrate abgelegt. Die Entwicklung bis zum erwachsenen Tier dauert dann ungefähr 4 Wochen.
In Gewächshäusern treten überwiegend Arten von Sciara und Bradysia auf. Die Larven von Orfelia sind bedeutend größer und schlanker, in Wurzeln wurden 15-20 mm lange Exemplare gefunden. Die Adulten sind mit 8-10 mm ebenfalls viel größer als Trauermücken und unterscheiden sich auch deutlich im Habitus, der Hinterleib der Mücke ist beispielsweise horizontal gestreift. Die meisten Vertreter dieser Mückengattung leben weltweit in Pilzen, verpilzten Substraten, in Moosen oder unter der Rinde von Bäumen. Das lässt vermuten dass die Mücke durch Substratlieferungen mit Rinde und Sphagnum in Orchideenbetriebe verschleppt wurde.
Schadbild
In feuchten Substraten fressen die Larven an zarten Wurzeln, als Folge können parasitäre Wurzelpilze in die Pflanzen eindringen. Bei stärkerem Befall wird die Substratstruktur durch Bildung feinkrümeliger Substanzen relativ schnell zerstört. Das kann an Orchideen als der eigentliche Schaden betrachtet werden.
Orfelia frisst in den dicken Wurzeln verschiedener Orchideen, Bei anderen Arten wird der Stammgrund stark geschädigt, während die feineren Wurzeln zunächst unbeschädigt bleiben. Meist sind in geschädigten Pflanzen nur sehr wenige Larven zu finden, häufig ist sogar nur eine einzige Larve für den beobachteten Schaden verantwortlich. Auffallend sind auch die deutlich sichtbaren Schleimspuren auf der Substratoberfläche. Betroffen sind neben Phalaenopsis und Miltonia auch andere Topforchideen wie Dendrobium , Oncidium oder Cambria- Hybriden.
Orfelia frisst in den dicken Wurzeln verschiedener Orchideen, Bei anderen Arten wird der Stammgrund stark geschädigt, während die feineren Wurzeln zunächst unbeschädigt bleiben. Meist sind in geschädigten Pflanzen nur sehr wenige Larven zu finden, häufig ist sogar nur eine einzige Larve für den beobachteten Schaden verantwortlich. Auffallend sind auch die deutlich sichtbaren Schleimspuren auf der Substratoberfläche. Betroffen sind neben Phalaenopsis und Miltonia auch andere Topforchideen wie Dendrobium , Oncidium oder Cambria- Hybriden.
Bekämpfung
Gewächshäuser müssen sauber und frei von nassen, veralgten und vermoosten Stellen sein. Zur Befallskontrolle sind gelbe Fangtafeln geeignet. Gegen die Larven von Sciara und Bradysia im Substrat kann mit Carbofuran gestreut werden. Gut wirksam sind auch sogenannte Häutungshemmer (z.B. Teflubenzuron), welche die weitere Entwicklung der Larven zum erwachsenen Tier verhindern.
Gelbe Fangtafeln eignen sich relativ gut zur Kontrolle von Orfelia, außerdem können Lichtfallen aufgehängt werden. Um die Anwesenheit von Larven zu überprüfen, sollten Substrate auf Schleimspuren untersucht und schwach wachsende Pflanzen an den Wurzeln kontrolliert werden. Es kann auch ganz sinnvoll sein nicht nur im Pflanzenbestand sondern auch im Arbeitsraum in der Nähe künstlicher Lichtquellen sowie im Substratlager Gelbtafeln aufzuhängen. Die chemische Bekämpfung der Larven ist kaum möglich. Es besteht keine ausreichende Wirkung mit Methiocarb und Teflubenzuron.
Gelbe Fangtafeln eignen sich relativ gut zur Kontrolle von Orfelia, außerdem können Lichtfallen aufgehängt werden. Um die Anwesenheit von Larven zu überprüfen, sollten Substrate auf Schleimspuren untersucht und schwach wachsende Pflanzen an den Wurzeln kontrolliert werden. Es kann auch ganz sinnvoll sein nicht nur im Pflanzenbestand sondern auch im Arbeitsraum in der Nähe künstlicher Lichtquellen sowie im Substratlager Gelbtafeln aufzuhängen. Die chemische Bekämpfung der Larven ist kaum möglich. Es besteht keine ausreichende Wirkung mit Methiocarb und Teflubenzuron.
Biologischer Pflanzenschutz
Räuberische Nematoden ( Steinernema feltiae Filipjev):
Bei Befall mit Bradysia oder Orfelia empfiehlt sich der Einsatz von insektenpathogenen Nematoden der Art Steinernema und Heterorhabditis . Die Dauerlarven der Nematoden sind in der Lage Schädlingslarven aufzusuchen und durch Körperöffnungen in sie einzudringen. Durch Absonderung eines Bakteriums kommt es zur Auflösung der Zellstrukturen in der Trauermückenlarve. Nach wenigen Tagen stirbt diese ab.
Der Bekämpfungserfolg ist daran zu erkennen, dass parasitierte Trauermückenlarven an die Substratoberfläche kommen und ein milchiges Aussehen angenommen haben. Je nach Befallsdruck werden 250.000 bis 500.000 Nematoden je m² im Gießverfahren ausgebracht. Zweckmäßig sind Anwendungen bei pikierten Jungpflanzen, wobei Meristeme scheinbar etwas anfälliger sind als Sämlinge. Da es sich bei Orfelia um eine relativ große Larve handelt sind. Heterorhabditis sicherlich besser geeignet als Steinernema , die wiederum sehr gut gegen die meist in Kombination vorkommenden Trauermückenlarven wirkt. Da eine Differenzierung welche der möglichen Mückenlarven im Einzelfall für Schäden verantwortlich ist schwierig ist, bietet sich eine kombinierte Behandlung mit beiden Nematodenarten an.
Insektenpathogene Bakterien ( Bacillus thuringiensis israelensis = B.t.i.): Präparate mit dem Bakterium B.t.i. ( Biomükk , Vectobac ) werden im Gießverfahren über die Pflanze ausgebracht. Das Bakterium bildet Dauersporen und gleichzeitig Eiweißkristalle (sog. Endotoxinkristalle) aus. Werden diese bakteriellen Produkte von empfindlichen Insekten gefressen, zerstören die Kristalle die Zellen der Darmwand. Es kommt zum Eindringen in den Körper, die Insekten sterben innerhalb kurzer Zeit ab. B.t.i. ist kein Kontaktmittel sondern ein reines Fraßgift. Nach Aufnahme des Bakteriums tritt ein relativ schneller Fraßstopp der Larven ein. Je kleiner und jünger die Larven, desto schneller und besser wirken auch die eingesetzten Präparate. B.t.i. wirkt ausschließlich gegen Mückenlarven.
Die Bakterien haben gegenüber eine wesentlich kürzere Lebensdauer. Meist ist die Wirkung nach spätestens einer Woche nicht mehr vorhanden, so dass bei festgestelltem Befall mehrere Applikationen notwendig sind. Zu beachten ist auch, dass keine Wirkung gegen Adulte, Puppen oder Eier stattfindet, sondern lediglich die Nahrung aufnehmenden Larven erreicht werden.
In Orchideen sollten aufgrund des relativ hohen Schadpotentials von Orfelia begleitende Maßnahmen mit Nematoden oder B.t.i. durchgeführt werden, bis keine Larven oder Adulte mehr gesehen werden.
Der Bekämpfungserfolg ist daran zu erkennen, dass parasitierte Trauermückenlarven an die Substratoberfläche kommen und ein milchiges Aussehen angenommen haben. Je nach Befallsdruck werden 250.000 bis 500.000 Nematoden je m² im Gießverfahren ausgebracht. Zweckmäßig sind Anwendungen bei pikierten Jungpflanzen, wobei Meristeme scheinbar etwas anfälliger sind als Sämlinge. Da es sich bei Orfelia um eine relativ große Larve handelt sind. Heterorhabditis sicherlich besser geeignet als Steinernema , die wiederum sehr gut gegen die meist in Kombination vorkommenden Trauermückenlarven wirkt. Da eine Differenzierung welche der möglichen Mückenlarven im Einzelfall für Schäden verantwortlich ist schwierig ist, bietet sich eine kombinierte Behandlung mit beiden Nematodenarten an.
Insektenpathogene Bakterien ( Bacillus thuringiensis israelensis = B.t.i.): Präparate mit dem Bakterium B.t.i. ( Biomükk , Vectobac ) werden im Gießverfahren über die Pflanze ausgebracht. Das Bakterium bildet Dauersporen und gleichzeitig Eiweißkristalle (sog. Endotoxinkristalle) aus. Werden diese bakteriellen Produkte von empfindlichen Insekten gefressen, zerstören die Kristalle die Zellen der Darmwand. Es kommt zum Eindringen in den Körper, die Insekten sterben innerhalb kurzer Zeit ab. B.t.i. ist kein Kontaktmittel sondern ein reines Fraßgift. Nach Aufnahme des Bakteriums tritt ein relativ schneller Fraßstopp der Larven ein. Je kleiner und jünger die Larven, desto schneller und besser wirken auch die eingesetzten Präparate. B.t.i. wirkt ausschließlich gegen Mückenlarven.
Die Bakterien haben gegenüber eine wesentlich kürzere Lebensdauer. Meist ist die Wirkung nach spätestens einer Woche nicht mehr vorhanden, so dass bei festgestelltem Befall mehrere Applikationen notwendig sind. Zu beachten ist auch, dass keine Wirkung gegen Adulte, Puppen oder Eier stattfindet, sondern lediglich die Nahrung aufnehmenden Larven erreicht werden.
In Orchideen sollten aufgrund des relativ hohen Schadpotentials von Orfelia begleitende Maßnahmen mit Nematoden oder B.t.i. durchgeführt werden, bis keine Larven oder Adulte mehr gesehen werden.
Weichhautmilben
Biologie
Weichhaut- oder Fadenfußmilben (Tarsonemidae) sind sehr kleine, etwa 0,2-0,3 mm lange, elliptische, glasig-durchscheinende Milben, versteckt lebend direkt am Vegetationspunkt bzw. im Herz der Pflanzen. Das vierte Beinpaar ist immer anders gestaltet als das dritte Beinpaar, bei Tarsonemus pallidus Banks ist es deutlich sichtbar kräftig ausgebildet.
Die Milben vermehren sich bei hohen Temperaturen und hoher relativer Luftfeuchtigkeit. Die Entwicklung vom Ei zum erwachsenen Tier dauert bei 20-25 °C etwa 14 Tage. Milben sind lichtempfindlich und bevorzugen junges, weiches Pflanzengewebe.
Die Milben vermehren sich bei hohen Temperaturen und hoher relativer Luftfeuchtigkeit. Die Entwicklung vom Ei zum erwachsenen Tier dauert bei 20-25 °C etwa 14 Tage. Milben sind lichtempfindlich und bevorzugen junges, weiches Pflanzengewebe.
Schadbild
Blätter sind eingebuchtet bis verbogen, Blütenstiele kürzer, manchmal mit seitlichen Nekrosen, die Blüten deformiert. Stammgrund zuweilen mit kleineren Faulstellen. Seltener an Phalaenopsis vorkommend. Häufiger an Aerangis , Paphiopedilum oder Dendrobium.
Bekämpfung
Hohe Luftfeuchtigkeit nach Möglichkeit reduzieren. Spritzungen mit chemischen Präparaten wiederholt durchführen mit Fenpyroximat, Abamectin, Tebufenpyrad, Fenpropathrin.
Biologischer Pflanzenschutz
Biologische Bekämpfung möglich mit Amblyseius-Raubmilben. Da die Raubmilben sich aber in Orchideen nur schwer etablieren lassen, ist eine Anwendung im Streuverfahren nicht zweckmäßig. Erfolgversprechend ist die Ausbringung im Tütensystem, die Raubmilben können dann langsam aus den Tüten in den Pflanzenbestand abwandern.
Wollläuse
Biologie
Woll- oder Schmierläuse ( Pseudococcidae ) gehören systematisch zu den Schildläusen. Die Vertreter dieser Familie sind allerdings nicht mit einen deckelartigen Schild besetzt, die erwachsenen Tiere sind mit mehligem Wachsdekret bepudert. Körperrand mit Dornen versehen, besonders am Hinterende zum Teil lange Wachsfäden. Vermehrung meist über Eier, einzelne Arten bei günstigen Bedingungen aber auch überwiegend lebendgebärend.
In Mitteleuropa sind in Orchideen zwei Arten von Bedeutung.
Zitronenschmierlaus (Planococcus citri Risso):
3-5 mm lang, oval dunkelgelb bis gelblichbraun gefärbt, mit Wachsausscheidungen bepudert, kurze und dicke Filamente am Körperrand. Sehr polyphag lebend mit starken Honigtauausscheidungen. Die gelben Eier werden in Wollmassen am Hinterleib abgelegt, Temperaturoptimum liegt bei 24 °C.
Langdornige Schmierlaus (Pseudococcus longispinus Targ.-Tozz. [= Pseudococcus adonidum L.]):
3-5 mm lange, rötlich bis orange gefärbte, ovale Wolllaus. Charakteristisch ist die Länge der Schwanzfäden (Filamente), die etwa so lang wie der Körper der Tiere sind. Extrem starke Honigtauausscheidungen.
Die Tiere stammen aus tropischen Regionen weltweit und haben sich in den letzten Jahren als Hauptschädling in Orchideenkulturen entwickelt. Sie sitzen häufig in Massen unter den Blättern, an Blütenstielen und Blütenblättern sowie an vielen Stellen, wo sie eigentlich keine Nahrung finden können, z.B. Topfränder, Kisten, Stellflächen, Gewächshauskonstruktionen, Substrate, Transportgefäße etc.
Zitronenschmierlaus (Planococcus citri Risso):
3-5 mm lang, oval dunkelgelb bis gelblichbraun gefärbt, mit Wachsausscheidungen bepudert, kurze und dicke Filamente am Körperrand. Sehr polyphag lebend mit starken Honigtauausscheidungen. Die gelben Eier werden in Wollmassen am Hinterleib abgelegt, Temperaturoptimum liegt bei 24 °C.
Langdornige Schmierlaus (Pseudococcus longispinus Targ.-Tozz. [= Pseudococcus adonidum L.]):
3-5 mm lange, rötlich bis orange gefärbte, ovale Wolllaus. Charakteristisch ist die Länge der Schwanzfäden (Filamente), die etwa so lang wie der Körper der Tiere sind. Extrem starke Honigtauausscheidungen.
Die Tiere stammen aus tropischen Regionen weltweit und haben sich in den letzten Jahren als Hauptschädling in Orchideenkulturen entwickelt. Sie sitzen häufig in Massen unter den Blättern, an Blütenstielen und Blütenblättern sowie an vielen Stellen, wo sie eigentlich keine Nahrung finden können, z.B. Topfränder, Kisten, Stellflächen, Gewächshauskonstruktionen, Substrate, Transportgefäße etc.
Schadbild
Hoher Verschmutzungsgrad durch Honigtau und nachfolgende Besiedlung mit Schwärzepilzen (Rußtau). Bei Massenauftreten von Wollläusen Deformationen der Blätter, starke Wachstumshemmungen, Saugstellen bei einzeln sitzenden Tieren von gelben bis rötlichen Flecken umgeben. Wollläuse häufig in Massen unter den Blättern, an Blütenstielen und Blütenblättern. Sehr versteckte Lebensweise, bei Phalaenopsis und Paphiopedilum sitzen die Tiere oft tief in den Blattscheiden.
Man kann beobachten, dass es gerade bei der Blüteninduktion der Orchideen, die durch Temperatursenkung hervorgerufen wird, zu einem Massenauftreten der Läuse kommt. Diese Vermehrung ist wahrscheinlich darauf zurückzuführen, dass die Pflanzen unter Stress stehen und somit anfälliger für Schädlinge und Krankheiten sind. Ein Grund für die vermehrte Ansiedelung der Läuse am Blütenstängel oder den Blüten selber ist vermutlich die erhöhte Aminosäurenkonzentration in diesen Pflanzenteilen.
Man kann beobachten, dass es gerade bei der Blüteninduktion der Orchideen, die durch Temperatursenkung hervorgerufen wird, zu einem Massenauftreten der Läuse kommt. Diese Vermehrung ist wahrscheinlich darauf zurückzuführen, dass die Pflanzen unter Stress stehen und somit anfälliger für Schädlinge und Krankheiten sind. Ein Grund für die vermehrte Ansiedelung der Läuse am Blütenstängel oder den Blüten selber ist vermutlich die erhöhte Aminosäurenkonzentration in diesen Pflanzenteilen.
Bekämpfung
Bei der chemischen Bekämpfung von Wollläusen müssen längerfristige Pflanzenschutzmaßnahmen eingeplant werden. Ein Knockdown-Effekt wie er z.B. von der Blattlausbekämpfung bekannt ist, ist hier nicht zu erzielen.
Der erste Schritt zur Verhinderung eines Befalls liegt in sorgfältiger Kontrolle von Importmaterial. Auf Wollläuse ist dabei in Blattachseln und Triebspitzen zu achten, unbemerkt eingeschleppte Schädlinge können sich oft über mehrere Monate versteckt halten bis es zu sichtbaren Schäden an den Kulturen kommt. Solange sich ein Befall auf wenige Pflanzen beschränkt, sollten diese vernichtet werden. Sobald sich aber an mehreren Stellen Symptome zeigen oder sich ein zunächst nicht sichtbarer Befall zum Problem ausweitet, sind chemische Maßnahmen unumgänglich.
Der günstigste Zeitpunkt einer chemischen Bekämpfung liegt während des Schlüpfens der Jungtiere. In diesem Stadium ist mit Insektiziden der höchste Wirkungsgrad zu erzielen. Wollläuse lassen sich noch relativ gut bekämpfen, solange keine Wachswolle gebildet ist. Da sich aber immer alle Stadien gleichzeitig auf den Pflanzen befinden, also auch ständig Jungtiere nachkommen, außerdem die Larvenentwicklung sehr lange dauert, müssen wiederholte Behandlungen im Abstand von 10-14 Tagen durchgeführt werden.
Der erste Schritt zur Verhinderung eines Befalls liegt in sorgfältiger Kontrolle von Importmaterial. Auf Wollläuse ist dabei in Blattachseln und Triebspitzen zu achten, unbemerkt eingeschleppte Schädlinge können sich oft über mehrere Monate versteckt halten bis es zu sichtbaren Schäden an den Kulturen kommt. Solange sich ein Befall auf wenige Pflanzen beschränkt, sollten diese vernichtet werden. Sobald sich aber an mehreren Stellen Symptome zeigen oder sich ein zunächst nicht sichtbarer Befall zum Problem ausweitet, sind chemische Maßnahmen unumgänglich.
Der günstigste Zeitpunkt einer chemischen Bekämpfung liegt während des Schlüpfens der Jungtiere. In diesem Stadium ist mit Insektiziden der höchste Wirkungsgrad zu erzielen. Wollläuse lassen sich noch relativ gut bekämpfen, solange keine Wachswolle gebildet ist. Da sich aber immer alle Stadien gleichzeitig auf den Pflanzen befinden, also auch ständig Jungtiere nachkommen, außerdem die Larvenentwicklung sehr lange dauert, müssen wiederholte Behandlungen im Abstand von 10-14 Tagen durchgeführt werden.
Biologischer Pflanzenschutz
Leptomastix dactylopii :
Eine kleine, 3 mm große Schlupfwespe, sehr effektiv gegenüber Planococcus citri . Tier ist gelb-braun gefärbt, macht kurze, hüpfende Sprünge. Hohe Temperaturen von mindestens sind 24-27 °C für optimale Entwicklung notwendig. Dann werden Eier in ausreichender Zahl in das dritte Nymphenstadium und in erwachsene Wollläuse gelegt. Hohe Lichtintensitäten sind erforderlich, Einsatz im Sommer sinnvoll. Pseudococcus wird durch die Schlupfwespe nicht parasitiert.
Leptomastidea abnormis :
Gelb-braun gefärbt, nur etwa 2 mm lang. Nur Planococcus citri wird parasitiert. Temperaturen von 20-24 °C sind für die Entwicklung der Schlupfwespe ideal. Da das Tier geringere Ansprüche an Licht stellt, kann es auch im Frühjahr und Herbst eingesetzt werden.
Cryptolaemus montrouzieri :
Der Australische Marienkäfer ist 4 mm groß, orange gefärbt mit schwarzen Flügeldecken. Die Larven sind ca. 13 mm lang, mit weißem, wachsartigen Material bepudert. Cryptolaemus ist ein Räuber, der alle bekannten Wolllausarten frisst. Auch die Eigenschaft dass er für Befallsherde geeignet ist, macht die Ausbringung des Nützlings interessant. Der Käfer macht in der Regel keine vollständige Entwicklung im Gewächshaus durch.
Auch zeigt er kein besonderes Interesse an Pseudococcus longispinus und bevorzugt andere Wollläuse. Da junge Larven des Marienkäfers bevorzugt Eier fressen und die Weibchen von Pseudococcus longispinus keine Eipakete ablegen, liegt in der fehlenden Nahrung auch ein Grund für die geringen Erfolge. Gegen Planococcus citri allerdings ist die Fraßleistung des Käfers ausreichend.
Eine kleine, 3 mm große Schlupfwespe, sehr effektiv gegenüber Planococcus citri . Tier ist gelb-braun gefärbt, macht kurze, hüpfende Sprünge. Hohe Temperaturen von mindestens sind 24-27 °C für optimale Entwicklung notwendig. Dann werden Eier in ausreichender Zahl in das dritte Nymphenstadium und in erwachsene Wollläuse gelegt. Hohe Lichtintensitäten sind erforderlich, Einsatz im Sommer sinnvoll. Pseudococcus wird durch die Schlupfwespe nicht parasitiert.
Leptomastidea abnormis :
Gelb-braun gefärbt, nur etwa 2 mm lang. Nur Planococcus citri wird parasitiert. Temperaturen von 20-24 °C sind für die Entwicklung der Schlupfwespe ideal. Da das Tier geringere Ansprüche an Licht stellt, kann es auch im Frühjahr und Herbst eingesetzt werden.
Cryptolaemus montrouzieri :
Der Australische Marienkäfer ist 4 mm groß, orange gefärbt mit schwarzen Flügeldecken. Die Larven sind ca. 13 mm lang, mit weißem, wachsartigen Material bepudert. Cryptolaemus ist ein Räuber, der alle bekannten Wolllausarten frisst. Auch die Eigenschaft dass er für Befallsherde geeignet ist, macht die Ausbringung des Nützlings interessant. Der Käfer macht in der Regel keine vollständige Entwicklung im Gewächshaus durch.
Auch zeigt er kein besonderes Interesse an Pseudococcus longispinus und bevorzugt andere Wollläuse. Da junge Larven des Marienkäfers bevorzugt Eier fressen und die Weibchen von Pseudococcus longispinus keine Eipakete ablegen, liegt in der fehlenden Nahrung auch ein Grund für die geringen Erfolge. Gegen Planococcus citri allerdings ist die Fraßleistung des Käfers ausreichend.
Wurzelmilben
Biologie
Moder- und Wurzelmilben (Tyroglyphidae)
Die relativ große Wurzelmilbe Rhizoglyphus echinopus Fum. et Rob. ist etwa 0,7-1,5 mm lang, der Körper ist oval und gedrungen, birnenförmig, weißlich glänzend. Beine braun mit kräftigen Dornen. Eier sind weiß, ebenfalls groß und werden an Pflanzenteile abgelegt. Die Entwicklung der Milbe wird bei hoher Luftfeuchtigkeit begünstigt.
Lebt allgemein als Sekundärschädling an Wurzeln schon geschwächter oder kranker Pflanzen. Schafft durch Wurzelzerstörung Eintrittspforten für pathogene Pilze, verschleppt auch Pilzsporen. Rhizoglyphus kann auch die Basis unterer, auf dem Substrat aufliegender Blätter schädigen. Die Modermilben der Gattung Tyrophagus haben einen gedrungenen Körper, sind weißlich gefärbt mit starker Behaarung. Leben häufig zwischen den Blattscheiden wo es stellenweise zu Massenvermehrungen kommen kann.
Die relativ große Wurzelmilbe Rhizoglyphus echinopus Fum. et Rob. ist etwa 0,7-1,5 mm lang, der Körper ist oval und gedrungen, birnenförmig, weißlich glänzend. Beine braun mit kräftigen Dornen. Eier sind weiß, ebenfalls groß und werden an Pflanzenteile abgelegt. Die Entwicklung der Milbe wird bei hoher Luftfeuchtigkeit begünstigt.
Lebt allgemein als Sekundärschädling an Wurzeln schon geschwächter oder kranker Pflanzen. Schafft durch Wurzelzerstörung Eintrittspforten für pathogene Pilze, verschleppt auch Pilzsporen. Rhizoglyphus kann auch die Basis unterer, auf dem Substrat aufliegender Blätter schädigen. Die Modermilben der Gattung Tyrophagus haben einen gedrungenen Körper, sind weißlich gefärbt mit starker Behaarung. Leben häufig zwischen den Blattscheiden wo es stellenweise zu Massenvermehrungen kommen kann.
Schadbild
Rhizoglyphus fressen das Wurzelgewebe ab, Epidermis und Zentralzylinder bleiben bestehen. In beschädigten Pflanzenteilen Gänge mit den Milben sichtbar. Aufliegende Blätter können unter Umständen verbräunen und zerstört werden.
Tyrophagus können gelegentlich bei Massenauftreten schädlich werden, dann auch Schädigungen an gesundem Pflanzengewebe. Blütenstiele besonders von Paphiopedilum ähnlich dem Schaden durch Weichhautmilben gestaucht und mit nekrotischen Streifen. Befallene Blätter werden weichfaul.
Bekämpfung
Eine direkte Bekämpfung von Wurzelmilben ist nur begrenzt möglich, das Eintauchen des Wurzelballens in Akarizidlösung nur bei wertvollen Einzelpflanzen wirtschaftlich sinnvoll. Vermeidung der Vermehrung durch optimale Kulturführung und Stärkung der Wurzelbildung. Gegen Modermilben sind die gebräuchlichen Akarizide in der Regel ausreichend wirksam. Als natürliche Feinde von Wurzel- und Modermilben siedeln sich in Orchideenkulturen häufig Raubmilben und Gallmückenlarven an.